유럽의 백신 유익성-위해성 감시를 위한 ADVANCE 프로젝트 소개
Abstract
The vaccine benefit-risk assessment entails comprehensive and systematic evaluation of the major benefits and risks of vaccine based on information after a marketing authorization. In 2009, the influenza A (H1N1) pandemic led to the licensing of new H1N1 vaccines in many countries including Europe. The post-marketing evaluation and monitoring of H1N1 vaccines was carried out based on a project previously conducted in Europe. In 2013, the Accelerated Development of VAccine beNefit-risk Collaboration in Europe (ADVANCE) project was launched with the support of Innovative Medicines Initiative (IMI) to address the limitations reported in the previous project. ADVANCE consisted of seven Work Packages (WPs), each indicating the vaccine benefit-risk monitoring readiness across four areas: Governance, Data source, Methods, and Study. First, a model for vaccine surveillance and governance with various functions such as decision making, quality management, execution, and financial administration was established. Also, the project developed a tool to identify, collect, and link the data sources available for vaccine surveillance. In addition, various methodologies were reviewed to assess the infectious disease burden, vaccine coverage, and benefit-risk based on linked data sources in Europe. Guidelines were proposed for real-world vaccine surveillance studies. Accordingly, a variety of tools and programs were developed, including a code of conduct related to the benefit-risk assessment of vaccines, ADVANCE International Research Readiness (AIRR), CodeMapper, and VaccO. Since the end of the ADVANCE project in 2019, the Vaccine Monitoring Collaboration for Europe (VAC4EU) has been conducting effective and sustainable vaccine benefit-risk monitoring programs based on the vision and ideology of ADVANCE. This study explains the contents and findings of ADVANCE with emphasis on WPs and proposes directions for establishing a vaccine benefit-risk assessment system in Korea.
Key words: Vaccine, Benefit-risk, Post-marketing surveillance, Real-world evidence, Europe
서 론
백신은 시판 전 임상시험에서 제한된 기간 동안 비교적 적은 수의 피험자를 대상으로 안전성과 유효성을 평가하므로 시판 후에도 지속적으로 그 이후에 추가된 백신에 관련된 정보를 종합적으로 고려하여유익성과 위해성(benefit-risk)을 평가해야 한다[ 1– 3]. 특히 백신은 건강한 사람에게 접종하기 때문에 백신에 대한 대중의 신뢰를 제고하고, 백신으로 예방 가능한 질병의 유행을 막기 위한 감시 시스템을 구축하여 이상반응(adverse event)을 모니터링해야 한다. 미국, 유럽 등을 비롯한 여러 국가에서는 기존의 백신에서 문제가 발생하거나 새로운 백신이 도입되는 경우 신속하게 유익성-위해성을 평가하고자 오랜 기간에 걸쳐 체계적인 백신 감시 시스템을 구축하여 왔다. 유럽에서는 2008년 질병통제예방센터(European Centre for Disease Prevention and Control, ECDC)를 주축으로 유럽연합 회윈국들의 건강정보데이터베이스를 통합하여 백신 이상반응 감시 및 의사소통(Vaccine Adverse Event Surveillance and Communication, VAESCO) 컨소시엄을 설립한 바 있다[ 4]. 그러나 2009년 새로 도입된 인플루엔자 A (H1N1) 바이러스 백신을 감시하는 과정에서 적합한 데이터의 선별의 어려움, 정보 수집의 제한 및 이해관계자 간의 상호 협력 부족 등의 문제점이 발생하였고, 이를 보완하여 새로운 시판 후 백신 감시 체계를 구축하고자 2013년에 혁신신약계획조직(Innovative Medicines Initiative, IMI)을 주축으로 민관이 협업하는 Accelerated Development of VAccine beNefit-risk Collaboration in Europe (ADVANCE) 프로젝트를 수행하였다[ 4, 5]. 특히 최근 코로나바이러스감염증-19 (코로나19)의 세계적인 유행으로 신속허가 등의 방법을 통하여 긴급하게 백신이 도입됨에 따라 시판 후 추가적인 안전성 평가에 대한 관심이 더욱 높아졌다. 따라서 본 연구에서는 백신 유익성-위해성 감시 프레임워크를 체계적으로 구축한 ADVANCE 프로젝트의 내용과 산출물을 전반적으로 조사하여 향후 우리나라의 백신 유익성-위해성 평가 체계 구축을 위한 방향을 제안하고자 한다.
본 론
ADVANCE의 목표 및 참여기관
ADVANCE의 목표는 백신 유익성-위해성 정보를 신속하게 전달하는 감시 프레임워크 및 유익성-위해성 평가 분석 도구의 구축하는 것이다[ 6]. 구축된 프레임워크와 분석 도구는 보건 전문가, 공공 기관, 제약업체, 대중 등에게 시판된 백신 유익성-위해성 정보를 제공하고 규제기관의 의사 결정을 지원하는데 이용되었다[ 6]. 백신의 시판 후 감시에서 다양한 기관 간의 협력은 공공 및 민간 이해관계자 간의 상호 관계를 개선하고 투명성을 강화할 수 있으며, 신속한 데이터의 수집 및 공유를 가능하게 한다. ADVANCE에는 공중보건기관, ECDC, 유럽의약품청(European Medicines Agency, EMA), 국가 보건 규제당국, 연구기관, 백신 품목 허가권자 등 유럽 내 다양한 기관이 참여하여 민관협력을 도모하였다[ 5, 7, 8]. 각 기관별 역할을 살펴보면, 공중보건기관은 각국의 데이터를 수집하기 위한 백신 감시 네트워크를 개발하고, ECDC는 유럽 전역의 전염병 발생을 감시하며, EMA 와 보건 규제당국은 백신의 효과와 안전성을 평가 및 감독한다[ 5, 7]. 한편 연구기관은 백신 감시에 관련된 연구방법론을 개발하고 적용하며, 품목 허가권자는 백신의 생산 및 판매자로서 유익성-위해성 보고서를 작성하여 제출한다[ 5, 7].
ADVANCE의 구성
ADVANCE는 프로젝트를 세분화하는 업무 단위인 작업 패키지(Work Package, WP) 기준 총 7개로 구성되어 있고, 이 가운데 가장 핵심적인 세 가지 WP는 WP 1 (Best practice mechanisms), WP 3 (Data sources), WP 4 (Methods)이다( Figure 1) [ 9]. WP 1, WP 3, WP 4를 바탕으로 WP 5 (Proof-of-concept studies)에서는 개념증명연구(Proof-of-concept study)를 수행하였고, 최종적으로 WP 7 (Blueprint for benefit-risk assessment)에서 연구의 실행 가능성을 분석하였다[ 9]. WP 2 (Creation of synergies)는 WP 간의 시너지 창출을 통해 프로젝트를 지원하였으며 WP 6 (Project management & communication)은 전반적인 프로젝트 관리와 파트너 간 의사소통을 조정하였다[ 9, 10].
Figure 1.
Core structure of the ADVANCE project. The figure has been adapted from reference [ 6]. 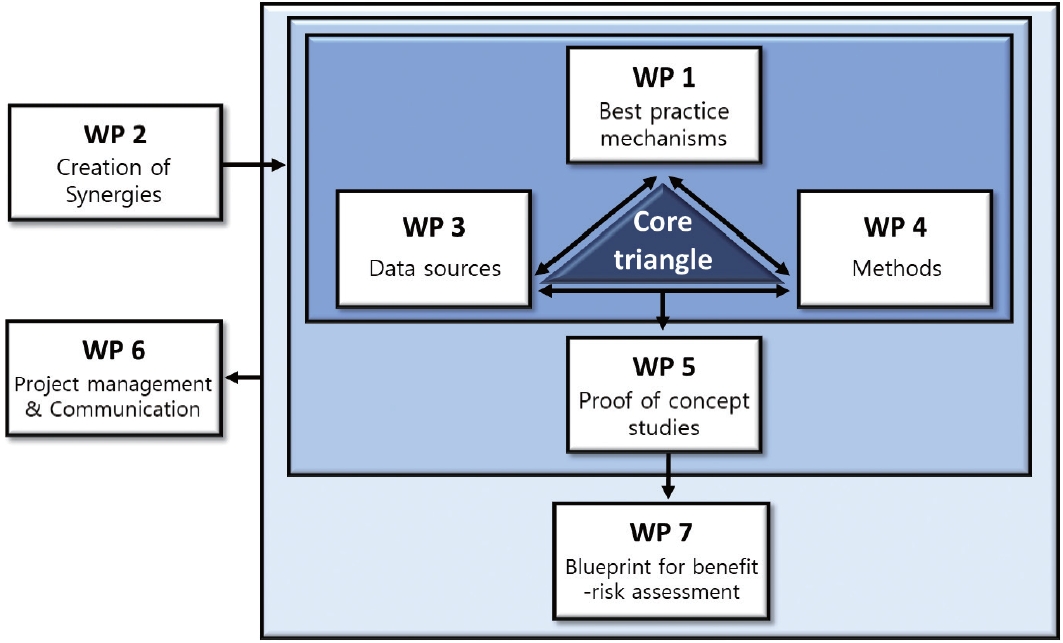
WP 1 - 백신의 유익성-위해성 감시를 위한 모범 사례 및 행동 규범
WP 1은 유럽에서의 백신 유익성-위해성에 대한 연구의 시작, 수행 및 보고를 위한 모범 사례 지침을 개발하는 것을 목적으로 하였고, 여기에는 거버넌스, 행동규범(code of conduct), 품질 요구사항, 의사소통 원칙이 포함되었다[ 11]. 거버넌스 측면에서 ADVANCE는 백신 유익성-위해성 감시에 관련된 여러 이해관계자를 포함한 기존의 거버넌스 모델을 분석하고, 자금 제공 주체에 따라 시나리오를 달리한 여러 모델들을 제시하였다[ 12]. 또한 모델에 포함되는 다양한 이해관계자들이 연구 수행 시 준수해야 할 행동규범을 과학적 진실성, 독립성, 투명성, 이해관계 상충, 연구 프로토콜, 연구 보고, 출판, 개인정보, 연구 데이터 공유, 연구 계약의 10가지 주제를 바탕으로 개발하였다[ 7, 11]. 뿐만 아니라 백신 유익성-위해성 평가 결과의 타당성과 신뢰성을 확보하고자 연구 전반에 걸쳐 최소 품질 요구사항과 감시 결과를 효과적으로 전달하기 위한 의사소통 전략을 제시하였다[ 13, 14].
WP 2 - 유럽의 유익성-위해성 감시를 위한 시너지 창출
WP 2의 목적은 각 WP에서 창출 가능한 시너지를 확인하는 것으로, WP 1은 민관 협력 모델 영역, WP 3은 데이터원 추출, 접근, 통합 및 데이터 수집 시스템 영역, WP 4는 백신의 유익성-위해성 평가와 감시 영역, 마지막으로 WP 5는 공통 데이터 모델(Common Data Model, CDM), 분산 네트워크, 데이터 공유 영역에서 다른 WP와의 시너지를 창출할 수 있음을 확인하였다[ 15].
WP 3 - 신속하고 통합된 유익성- 위해성 감시를 위한 데이터
WP 3은 이용 가능한 데이터의 목록화, 개인정보보호 및 연구윤리 가이드라인 개발, 기술 가이드라인 제공의 세 가지를 주요 목적으로 하였다[ 16]. 먼저 각 데이터의 백신 유익성-위해성 감시 준비도를 측정하는 ADVANCE International Research Readiness (AIRR) 조사를 개발하였고, 여기에는 데이터베이스 기본 정보, 데이터베이스가 포함하는 인구 및 지역, 데이터베이스 간 연계 및 데이터 접근에 소요되는 시간 등의 조사 항목이 포함되었다[ 16]. 이후 이를 기반으로 선정한 이용 가능한 데이터 목록 및 메타프로파일(meta-profiles)을 공유하고자 ADVANCE 웹 카탈로그(Web catalogue)를 구축하였다[ 16]. 그 외에도 데이터를 이용하는 연구자를 위하여 개인정보보호 및 연구윤리에 관한 Privacy and ethics guidance (PE-tool)를 개발하고, 데이터 수집과 연계 방법에 대한 가이드라인을 제공하였다[ 10].
WP 4 - 질병부담, 접종률, 백신 안전성과 효과성, 영향 및 유익성-위해성 감시를 위한 방법론
WP 4는 기존 백신 관련 연구 방법론을 조사 · 검토하고 백신의 접종률, 효과성, 안전성, 유익성-위해성을 신속하게 추정· 평가하는 새로운 방법론을 개발하는 것을 목적으로 하였다[ 17]. 우선 백신의 접종률을 추정하기 위하여 행정적 방법, 설문조사 방법, 전산화된 접종 기록을 이용하는 방법을 검토하고, 활용 가능한 데이터원을 파악하였다[ 17]. 이후 백신의 안전성 평가를 위한 코호트 연구, 환자 대조군 연구, 자신 대조 연구, 순차적 분석 등의 방법론을 조사 및 검토하고, 여기에 효과 측정치, 통계적 타당성, 적시성, 완건성, 운용 가능성의 다섯 가지 범주의 기준을 이용하여 각 방법론을 적용하기 적합한 상황과 고려 사항을 제시하였다[ 18]. 백신의 효과성 평가 분야에서는 국가 예방접종 프로그램의 도입 전후를 구분하여 도입 이전에는 무작위 임상 시험을 중심으로, 도입 이후에는 역학적 방법과 수리적 모델을 중심으로 효과성 평가 관련 방법론을 검토하였다[ 19]. 안전성 평가와 마찬가지로 통계적 기준, 시간적 기준, 완건성 기준, 운용적 기준, 윤리적 기준의 5가지 기준을 적용하여 조사한 방법론을 적용하기 적합한 상황을 평가하였다[ 19]. 마지막으로 백신 유익성-위해성 평가에 관련하여 유익성-위해성 측정치, 종합적 건강 지표, 기술적 프레임워크, 정량적 프레임워크, 의료 기술 평가 모델링 등 여러 방법론을 조사하고, 적시성과 통합성을 고려할 때 해당 방법론이 시판 후 백신 유익성-위해성 분석에 적절한지를 평가하였다[ 17, 20].
WP 5 - 백신 유익성-위해성 감시를 수행하기 위한 체계의 개념 증명 연구
WP 5는 백신 유익성-위해성의 지속적인 모니터링을 위한 워크플로우(workflow)를 고안하고, 개념증명연구를 실시하는 것을 목적으로 하였다[ 21]. ADVANCE 통합 워크플로우는 연구 질문 설정, 데이터원 선정, 연구진 구성, 프로토콜 작성, 데이터 추출/확인, 데이터 변환, 분석의 여러 단계로 구성되어 있다[ 21]. 데이터 추출과정은 Data Access Providers (DAPs)가 연구별 지침과 프로그램을 전송받아 로컬 데이터베이스에서 환자, 예방접종, 이상반응 등의 데이터를 추출하면 ADVANCE CDM에 따라 변환되고, 변환된 데이터는 프로그래밍되어 전송받은 JAVA기반의 Jerboa 및 R스크립트를 통해 원격 연구 환경(Remote Research Environment, RRE)으로 전송되어 최종적으로 ADVANCE 파트너들이 이용할 수 있도록 하였다( Figure 2) [ 21].
Figure 2.
The infrastructure of the ADVANCE system for data extraction, transformation and analysis. The figure has been adapted from reference [ 23]. 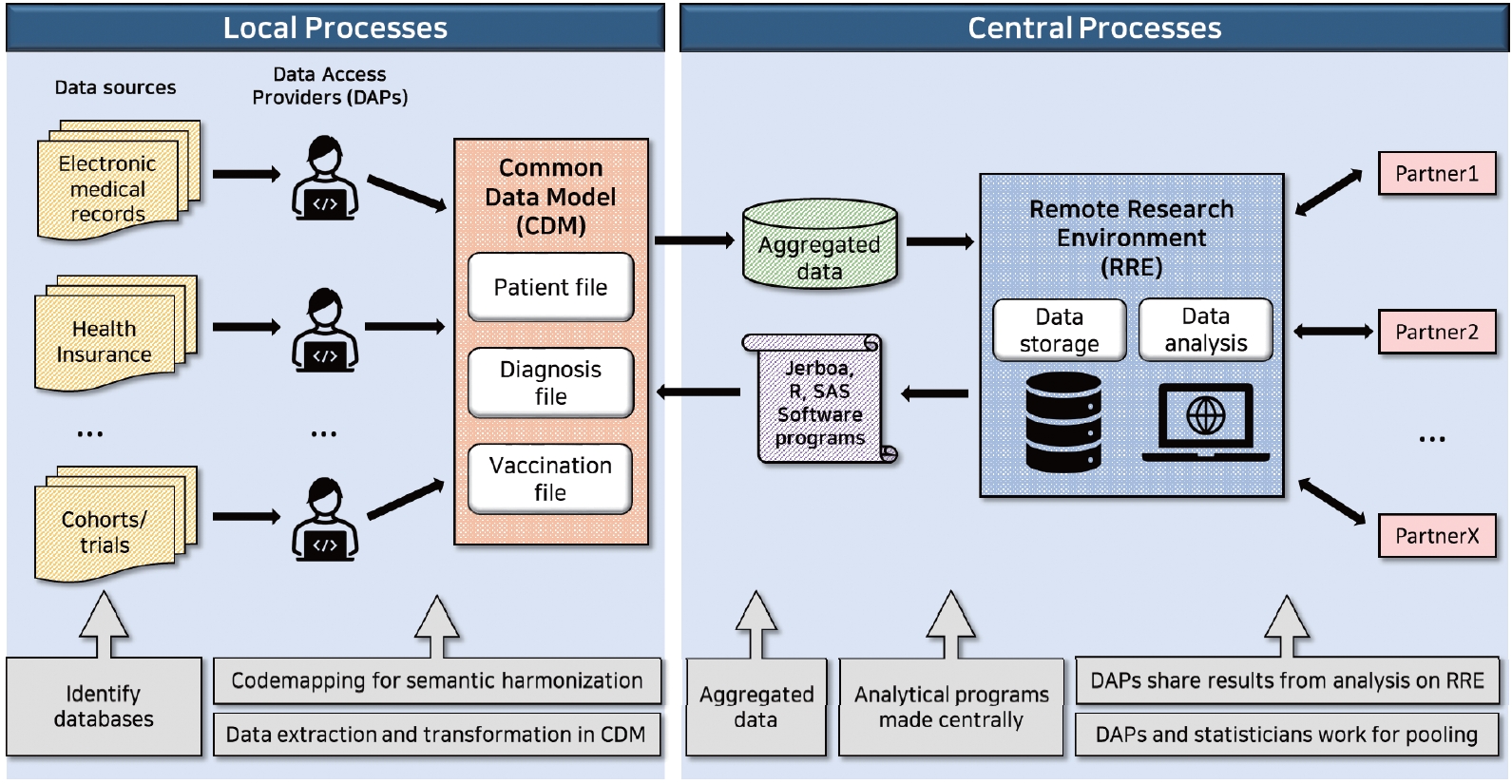
개념증명연구는 ADVANCE 시스템이 다른 데이터원을 이용한 연구 결과와 비슷한 결과를 생성할 수 있는지를 살펴봄으로써 ADVANCE 에서 산출한 근거의 타당성을 평가하기 위하여 설계되었다[ 22]. 먼저 유럽 내 4개 국가의 9개 데이터베이스에 대한 적합성을 평가한 후 이를 활용한 두 가지의 개념증명연구가 실시되었다[ 23]. 첫 번째는 전세포 백일해 백신과 무세포 백일해 백신의 접종률, 안전성, 효과성 및 유익성-위해성 비교 연구를 실시하였고, 그 결과 유럽의 여러 데이터베이스와 공통의 프로토콜, 방법론을 이용하는 백신 유익성-위해성 근거 산출의 타당성을 입증하였다[ 22, 24– 29]. 두 번째는 백일해 백신을 대상으로 실시간에 가까운 전향적인 감시를 수행하였고 유럽에서 데이터 지연이 거의 없이 주(week) 단위 실시간 감시가 가능함을 확인하였다[ 30].
WP 6 - 프로젝트 관리 및 의사소통
WP 6은 ADVANCE의 이해관계자들 간 효율적인 상호작용을 도모할 수 있도록 의사소통, 관리 및 조정에 있어서 중요한 사항을 제시하는 것을 목적으로 하였다[ 9].
WP 7 - 연구 실행 가능성 분석
WP 7은 연구 실행 가능성을 분석하고, 최종적으로 ADVANCE에서의 백신 유익성-위해성 평가를 위한 프레임워크의 청사진을 제시하는 것을 목적으로 하였다[ 31]. 프레임워크 청사진은 WP 1에서 WP 6까지 다루었던 기술 인프라, 데이터원, 연구 방법론, 행동 규범, 관리 구조 등에 기초하여 개발되었으며, 여기에는 프레임워크를 실제 연구에 적용하기 위한 11단계의 매뉴얼( Table 1)과 ADVANCE 프로젝트 종료 이후 프레임워크의 지속 가능성에 대한 논의가 포함되었다[ 31].
Table 1.
The steps of the generic study process using the framework of the ADVANCE project
|
Steps |
Purpose |
Description |
|
1 |
Activation of the framework |
The situations in which the framework could be continuously activated are as follows: |
|
• Benefit-risk monitoring: when there is a particular benefit-risk issue or if a new vaccine is introduced in the national vaccination program. |
|
• Benefit assessment: when the benefits of vaccines are suspected, such as mutations in pathogens, weakened immunity, and the suboptimal effectiveness of a vaccine in some population groups. |
|
• Safety assessment: when there is an anticipated adverse event (from pre-authorised studies or experience with similar vaccines) or when there is a signal of new suspicious/potential adverse events |
|
• Vaccination coverage: when there are vaccination coverage signs of depression, or when monitoring finds safety issues or when the incidence of disease increases. |
|
2 |
Defining the study question |
The study question will inform which study type and method to select, how to set up the study team, and which databases could potentially be used depending on the type of monitoring. |
|
3 |
Setting up the study team |
There are two conditions to take into account when setting up the study team. |
|
① Technical: expert knowledge, experience, databases. |
|
② Study governance: potential partners, rules for cooperation, funding. |
|
4 |
Deciding on the specific study governance |
Setting the stage for the study governance in ADVANCE project. |
|
① Design the study governance models to adapt to specific situations |
|
② Follow the detailed list of questions when choosing members of the governance group. |
|
5 |
Choosing the methods |
Scientific method(s) depend on the different questions. |
|
• Benefit-risk monitoring: descriptive or semi-quantitative frameworks, composite health measures, etc. |
|
• Benefit assessment: vaccine effectiveness, milder disease, etc. |
|
• Safety assessment: variants of cohort studies, variants of case-control studies, etc. |
|
• Vaccination coverage: administrative method, survey method, etc. |
|
6 |
Developing the study protocol and the statistical analysis plan |
By referring to protocols of the proof of concept (POC) studies conducted by ADVANCE, protocols can be written in a different way depending on each research question. |
|
7 |
Identifying available data sources |
Steps to identify the available/appropriate databases. |
|
① Consider databases used in ADVANCE Project POC studies. At this time detailed information can be obtained from ADVANCE Advanced International Research Readiness (AIRR) survey results. |
|
② Other suitable databases can be identified by a search of inclusive existing database catalogues (e.g. ENCePP Resources Database). |
|
8 |
Securing ethics and data protection approvals |
The study uses the Privacy and Ethics Guidelines (PE-Tool) to monitor ethical approval processes and data protection Further training experts using an electronic health database engaged in benefit-risk analysis of vaccines is also required. It focuses on laws and codes of practice on privacy, ethics approval, data protection, code of conduct, etc. |
|
9 |
Extraction and transformation of data |
The common steps in collecting and transforming data |
|
① Develop a common standardized parameter-set per study by using Jerboa, SAS or R |
|
② Extract study-specific data according to the Common Data Model (CDM) into a central depository |
|
③ Make storage accessible to the study team |
|
④ Ensure proper archiving and disposal of data |
|
10 |
Data analysis |
Data analysis is executed using proper methods for each research question. |
|
11 |
Developing a communication strategy |
Four stages of developing a communication strategy for the benefit-risk of vaccines in public-private collaborative research. |
|
① Setting and defining goals for communication strategies |
|
② Mapping stakeholders |
|
③ Develop content and core components |
|
④ Develop implementation and monitoring plans |
매뉴얼은 ADVANCE의 프레임워크에 따른 연구 수행을 위한 전반적인 과정을 제시하고 있다. 백신 감시가 필요한 다양한 상황에서 ADVANCE의 프레임워크가 활성화되면 연구 질문 설정, 연구진 구성, 거버넌스 모델을 결정하고 이후 감시에 필요한 방법론을 선정하고 연구 프로토콜을 개발하며, 이용 가능한 데이터를 확인 및 추출하여 분석하고, 분석 결과에 대한 의사소통 전략을 개발한다[ 31]. 한편 ADVANCE는 지속적인 시스템의 운영을 위해 다양한 선택지 가운데 ‘중앙 허브+플랫폼(central hub+platform)’ 접근법을 제시하였다[ 31]. 여기에서 중앙 허브는 연구 네트워크 및 이해관계자 간의 의사소통 및 조정에서 중심 역할을 하고, 각 로컬 데이터베이스를 관리하여 데이터와 분석 결과의 품질을 보증함으로써 백신 유익성-위해성에 대한 실제 임상 근거(Real-world evidence, RWE)를 제공할 수 있는 플랫폼을 제공하는 것을 목적으로 하였다[ 31].
ADVANCE프로젝트의 산출물
ADVANCE 프로젝트는 시스템 기반 및 거버넌스, 데이터, 방법론, 연구 수행의 네 가지 영역에서 여러 가지 성과를 산출하였다[ 12].
시스템 기반 및 거버넌스
시스템 기반 및 거버넌스의 측면에서 ADVANCE는 유럽의 다양한 공공 및 민간 기관 간의 협력 시스템을 구축하고자 하였고, 그 결과 연구기관, 공중 보건 기관, 의약품 규제 기관 등을 포함한 유럽 내 19개 국가의 48개 파트너 기관이 ADVANCE에 참여하였다( Supplementary Table 1) [ 5, 8]. ADVANCE에서는 이러한 파트너 기관들이 상호협력할 수 있도록 의사결정 기능, 과학적 자문 기능, 품질관리 및 감사 기능, 실행 및 관리 기능, 재무 관리 기능의 5가지 기능이 포함된 거버넌스 모델을 구축하였다[ 12]. 이때 ADVANCE에 참여하는 조직들의 역할 및책임은 거버넌스 모델에서 각 조직이 맡은 기능에 따라 결정된다[ 12].
데이터원
ADVANCE에서는백신의 유익성-위해성 감시에 적절한 데이터원을 확인하고자 필요한 정보를 포함하고 있으면서 이용 가능한 데이터원을선정하여 목록화하였다. 이 과정에서 감시 목적에 부합하는 적절한 데이터원을 확인하기 위해 개발된 AIRR 조사 도구가 이용되었다. AIRR 조사 도구에는 데이터베이스 기본 정보와 분류, 데이터의 접근 시간과 연계, 가용성, 데이터 품질 등을 확인하는 설문 문항들이 포함되어 있으며[ 10], AIRR 조사 도구를 사용하여 추출된 데이터 정보는 이후 ADVANCE 웹 카탈로그를 통해 모든 ADVANCE 관련 연구자들에게 제공되었다[ 16].
방법론
ADVANCE에서는 백신의 접종률과 효과성, 안전성, 유익성-위해성 평가를 위하여 여러 방법론을 조사하고, 상황에 따라 적절한 방법론을 적용할 수 있도록 정리하였다[ 18– 20]. 또한 백신의 유익성-위해성 근거를 생성하기 위하여 의학 정보를 처리하는 CodeMapper, 백신 정보를 처리하는 VaccO, 실시간 감시 대시보드 등 다양한 도구를 개발하였다. 유럽의 여러 전자건강기록 데이터베이스는 의학 용어 체계가 다양하기 때문에 자연어 형태의 사례 정의로부터 코드를 작성하는 것이복잡하며, 개별 코드의 포함·제외 근거가 문서화되지 않아 이후 재사용이 불가능하다[ 32, 33]. 웹 기반 응용프로그램인 CodeMapper는 이러한 문제점을 해결하면서 각기 다른 용어들의 사례 정의를 진단 코드와 매핑하고 전체 매핑 과정을 기록하는데 이용된다[ 32]. CodeMapper 의 매핑 과정은 크게 3단계로, 의학 개념이 자동적으로 확인되면 사용자는 의학 개념을 일반화 또는 구체화함으로써 매핑의 민감도를 향상시키고, 마지막으로 각 개념은 해당하는 용어의 코드로 제시된다[ 32]. 이와 더불어 백신 정보를 공통적으로 표현하고자 개발된 VaccO는 백신의 구성 요소, 원료, 제조업체 등의 속성과 상호관계, 계층 구조를 포함한 개념을 컴퓨터가 처리할 수 있는 형태로 표현하는 온톨로지(on-tology)이다[ 34]. 이는 백신 코드의 분석 및 선택, 각 데이터베이스에서의 백신 정보 추출, 자발적 보고 시스템에서의 백신 정보 코딩 등 다양한 상황에서 적용 가능하다[ 34]. 한편 백신 유익성-위해성 관련 요소들의 주기적인 변화를 평가할 수 있는 실시간 감시 대시보드도 개발되었다[ 6]. 이는 특히 상호작용형으로 구축되어 사용자가 직접 연령군, 기간 등의 특정 옵션을 선택할 수있다는 장점을 지닌다[ 6]. 대시보드의 구성 단계를 살펴보면 먼저 전처리 1단계에서 전자건강기록이 개인 수준의 분석 데이터셋으로 변환된 후 전처리 2단계에서 이를 기반으로 요약 테이블이 생성되고, 생성된 테이블이 차트 생성 함수에 입력되어 시각적으로 구현된다( Figure 3) [ 6]. ADVANCE에서는 두 차례에 걸쳐 모의 시뮬레이션을 수행하였는데, 첫 번째는 유럽 내 로타바이러스(rotavirus) 백신 도입 이후 모의 전자건강기록 데이터를 이용하여 시스템과 워크플로우를 테스트하기 위해 수행되었다[ 6]. 첫 번째 시뮬레이션이 성공적으로 이루어진 후 유럽 4개 국가(덴마크, 이탈리아, 스페인, 영국)에 있는 실제 전자건강기록 데이터베이스 9개를 이용하여 어린이에서의 무세포 백일해 예방접종을 감시하는 두 번째 시뮬레이션이 이루어졌다[ 30]. 특히 감시가 필요할 때 데이터가 적시에 제공될 수 있는지를 의미하는 적시성을 평가하기 위하여 1–2주 간격으로 데이터를 추출하였고, 그 결과 데이터 지연이 거의 없어 유럽에서 실시간에 가까운(near-real time) 백신 유익성-위해성 감시의 수행 가능성을 성공적으로 입증하였다[ 30].
Figure 3.
Architecture and screen of the ADVANCE interactive dashboard. The figure has been adapted from reference of supplementary material [ 8]. 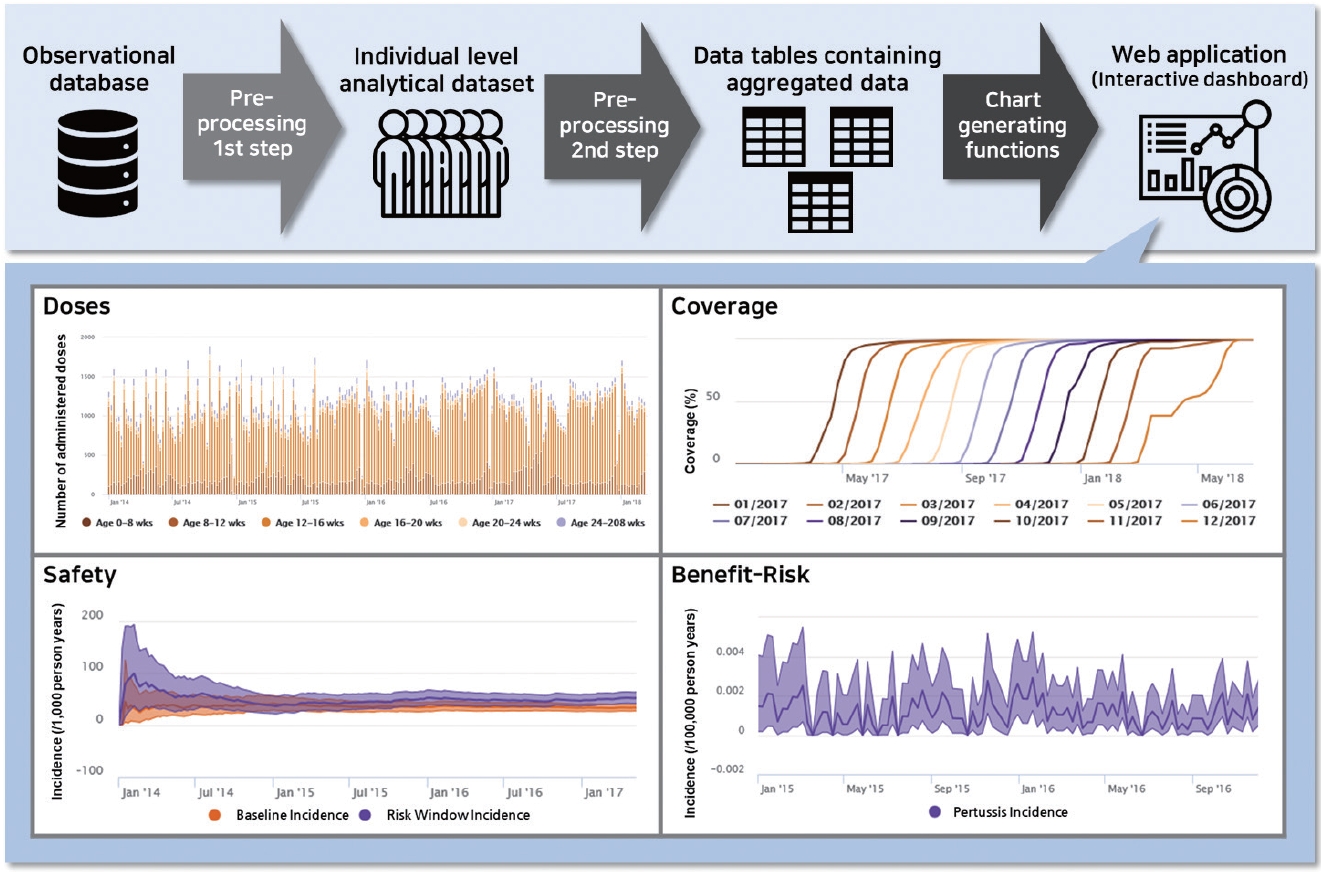
연구 수행
ADVANCE는 다중 데이터베이스를 이용한 백신 유익성-위해성 연구의 실제 수행을 위해 필요한 모범 사례 지침과 연구 개요, 프로토콜, 분석 계획 및 보고서의 템플릿을 제공하였다[ 8]. 또한 데이터에서 분석 시 필요한 SAS나 R 등의 프로그램들을 제공하여 원시 자료원에서 유익성-위해성 근거를 산출하는데 이용할 수 있도록 하고, 데이터 전송, 공유 및 풀링(pooling)을 위한 플랫폼을 개발하였다[ 8, 21].
고찰 및 결론
ADVANCE는 유럽에서 이용 가능한 보건의료 데이터베이스의 이차적인 이용에 초점을 두어 총 7가지 WP를 수행하여 백신의 유익성-위해성에 대한 과학적 근거를 제공할 수 있는 체계를 마련하였다는 점에서 중요한 의의를 지닌다[ 5]. ADVANCE 프로젝트에는 다양한 국가의 여러 기관들이 참여하기 때문에 지속 가능한 거버넌스 모델을 설립하고, 각 기관의 역할을 명확히 정의하여 유기적인 협력과 체계적인 감시가 이루어지도록 하였다[ 12]. 또한 감시에 필요한 데이터원을 선정하는 도구를 비롯하여 각 데이터베이스의 용어를 공통적으로 코딩하고, 효율적으로 활용하기 위한 시스템을 개발하였다[ 21]. 특히 상호작용형 실시간 대시보드를 통해 향후 백신의 유익성-위해성에 대한 실시간 감시 결과를 시간의 흐름에 따라 시각적으로 확인할 수 있도록 하여 규제기관의 의사결정 지원 등 다양한 활용 가능성을 제시하였다[ 6, 30]. 그 밖에도 실제 백신 유익성-위해성 연구를 지원하는 모범 사례 지침과 분석 플랫폼 개발 등을 통해 연구에서 높은 수준의 근거를 산출할수 있도록 하였다[ 12]. ADVANCE 프로젝트는 2019년 3월 종료되었지만 이후 ADVANCE에서의 성과를 지속적으로 활용하기 위한 Vaccine monitoring Collaboration for Europe (VAC4EU)가 설립되었고, 다양한 네트워크와의 협력을 통해 공중보건학적 의사결정을 지원하고 있다[ 35]. 이렇게 설립된 백신의 유익성-위해성 감시 프레임워크는 백신이 새로 도입되거나 새로운 안전성 문제가 제기될 때 신속하게 모니터링을 수행하는 기반이 될 수 있다. 그 예로 코로나19의 예방을 위한 백신이 개발됨에 따라 유럽에서 코로나19 백신 감시를 준비하기 위해 2020년 5월에 시작한 vACcine Covid-19 monitoring readinESS (ACCESS) 프로젝트가 있다[ 36]. ACCESS 프로젝트에서 주로 수행하는 연구에는 특별 관심 대상 이상 반응의 코드 정의, 배경발생률 산출을 위한 프로토콜 개발과 배경발생률 산출, 코로나19 백신의 시판 후 감시를 위한 템플릿 프로토콜 작성, 실시간에 가까운 감시를 위한 데이터 통합 계획 수립, 유럽연합 국가들의 연구 참여 능력 평가가 있다[ 36]. 이때 ACCESS의 수행에 ADVANCE와 VAC4EU의 도구 및 IT 인프라 등을 활용함으로써 대규모 민관 네트워크에 대한 접근이 용이하게 되었고, 체계적으로 확립된 거버넌스에 따라 프로젝트가 신속하게 이루어질 수 있었다[ 36, 37]. 우리나라는 현재 ‘의약품의 위해성관리계획 가이드라인’에 따라 의약품의 시판 후 정기적인 최신 안전성 정보 보고(Periodic Safety Update Reports, PSUR)를 통해 품목 허가권자가 의약품의 유익성-위해성 평가 결과를 정기적으로 제출하도록 하고 있다[ 38]. 그러나 ADVANCE와 같은 2차 데이터를 활용한 백신의 유익성-위해성에 관련하여 신뢰할 수 있는 RWE를 생성하는 시스템은 아직까지 구축되어 있지 않다. 우리나라는 백신의 유익성-위해성 감시를 위해 필요한 데이터가 여러 기관에 분산되어 있으므로 백신의 유익성-위해성 감시에 질병관리청의 예방접종 등록자료를 비롯하여 건강보험심사평가원 및 국민건강보험공단(이하 공단)의 건강보험 청구자료, 병원의 전자건강기록을 연계하여 활용하기 위해서는 자료 연계의 근거와 함께 분석 기반 및 과학적 근거가 도출되었을 때 정책적으로 활용할 수 있도록 관련 제도가 도입되어야 한다. ADVANCE에서 다양한 백신 유익성-위해성 평가를 위한 방법론을 검토하고 적용하기 위한 상황을 제시한 것과 같이 우리나라 자료원에 적용하기 적절한 방법론의 개발이 이루어져야 한다. 이와 더불어 공공 및 민간의 여러 기관 간의 협력을 통해 전문 지식의 공유가 이루어질 수 있도록 하는 방안을 마련하여야 한다. 특히 2021년 4월 질병관리청과 공단은 질병관리청에서 보유한 예방접종 정보·이상반응 정보· 접종자 정보와 공단에서 보유한 진료내역· 상병내역· 투약내역 등 의료이용정보를 연계한 코로나19 건강정보 빅데이터를 구축하기 위한 업무협약을 체결하였다. 최근 10월 4일 식품의약품안전처의 보도자료에 따르면 식품의약품안전처와 질병관리청, 공단 간의 데이터 연계 협력도 이루어지고 있어 향후 기관 간 자료의 연계가 더욱 적극적으로이루어질 것이며, 백신 유익성-위해성 근거의 산출이 더욱 용이해져 궁극적으로는 과학적 근거 기반 정책 수립에 큰 도움이 될 것으로 예상된다. 본 논문에서 다룬 유럽 ADVANCE 프로젝트를 참고하여 우리나라에서도 백신 안전성과 유익성-위해성 감시 시스템 인프라를 계획하고 구축함으로써 향후 기존 국가예방접종 백신 또는 코로나19 백신과 같이 새롭게 도입되는 백신의 안전성 및 유익성-위해성을 신속하게 확인할 필요가 있다. 이러한 시스템은 효과적인 예방접종 정책 수행 및 의사결정을 지원하는 근거를 생성하는데 기여할 수 있을 것이다.
REFERENCES
1. Jeong SH, Jang SM. A review of domestic and foreign drug benefit-risk assessment techniques. Yakhak Hoeji 2019;63(2):103-112. (Korean).10.17480/psk.2019.63.2.103.
2. Lee EK. Evidence-based benefit-risk assessment of medication. J Health Tech Assess 2013;1:22-26. (Korean).
4. Chen RT, Shimabukuro TT, Martin DB, Zuber PL, Weibel DM, Stur-kenboom M. Enhancing vaccine safety capacity globally: A lifecycle perspective. Am J Prev Med 2015;49(6 Suppl 4):S364-S376. 10.1016/j.amepre.2015.09.009.   5. Sturkenboom M, Bahri P, Chiucchiuini A, Grove Krause T, Hahne S, Khromava A, et al. Why we need more collaboration in Europe to en-hance post-marketing surveillance of vaccines. Vaccine 2020;38(Suppl 2):B1-B7. 10.1016/j.vaccine.2019.07.081.   6. Kurz X, Bauchau V, Mahy P, Glismann S, van der Aa LM, Simondon F. The ADVANCE Code of Conduct for collaborative vaccine studies. Vaccine 2017;35(15):1844-1855. 10.1016/j.vaccine.2017.02.039.   7. VAC4EU. VAccine monitoring Collaboration for Europe (VAC4EU). Available at https://vac4eu.org/.[accessed on December 19, 2020]. 9. ADVANCE. Deliverable 3.5. Procedures for data access, sharing, link-age and integration, including privacy and ethics. 2017.
10. ADVANCE. D3.4 Catalogue and meta-profiles of data sources for vaccine benefit-risk monitoring (Supplementary documentation). WP3 – Data sources for rapid and integrated benefit-risk monitoring. Version 2.2016.
11. ADVANCE. Good practice guidance module 2: Governance models. WP1 – Best practice and code of conduct for benefit-risk monitoring of vaccines. Deliverable 1.10 – Final conceptual models for public-pri-vate interaction. Version 5.2016.
13. ADVANCE. D1.13 White paper1 (recommendations) from WP1 for the final blueprint: governance guidance and Code of Conduct. WP1 – Best practice and code of conduct for benefit-risk monitoring vac-cines. Version 1 final.2017.
14. Torcel-Pagnon L, Bauchau V, Mahy P, Htar MTT, van der Sande M, Mahé C, et al. Guidance for the governance of public-private collabo-rations in vaccine post-marketing settings in Europe. Vaccine 2019;37(25):3278-3289. 10.1016/j.vaccine.2019.04.073.   15. ADVANCE. Good practice guidance WP1 – Best practice and code of conduct for benefit-risk monitoring of vaccines. Deliverable 1.9 Guidance on best practices – Modules 1 and 3. Version 2 final. 2016.
17. ADVANCE. Deliverable 2.4 Final report on landscape analysis, syner-gies, added value of synergies for ADVANCE and future opportuni-ties. 2017.
18. ADVANCE. D4.9 Work Package 4 White Paper: methods for vaccine benefit-risk monitoring, including vaccine coverage, safety and effectiveness. WP4 – Methods for burden of disease, vaccination coverage, vaccine safety and effectiveness, impact and benefit-risk. Version 1 fi-nal.2017.
19. ADVANCE. D4.1 Report on appraisal of methods for vaccine coverage, burden of disease and vaccine benefits. WP4 – Methods for burden of disease, vaccination coverage, vaccine safety & effectiveness, impact and benefit risk monitoring. Version 2 final.2014.
20. ADVANCE. D4.2 Report on appraisal of vaccine safety methods. WP4 – Methods for burden of disease, vaccination coverage, vaccine safety and effectiveness, impact and benefit-risk monitoring. Version 2 final.2014.
21. ADVANCE. D4.3 Report on appraisal of vaccine benefit-risk method-ology. WP4 Methods for burden of disease, vaccination coverage, vac-cine safety and effectiveness, impact and benefit-risk monitoring. Version 2 final.2014.
22. ADVANCE. Deliverable 5.4. Fingerprinting of the participating healthcare databases..2019.
23. ADVANCE. Deliverable 5.6. Results of POC-phase 1 studies..2017.
24. Sturkenboom M, Braeye T, van der Aa L, Danieli G, Dodd C, Duarte-Salles T, et al. ADVANCE database characterisation and fit for purpose assessment for multi-country studies on the coverage, benefits and risks of pertussis vaccinations. Vaccine 2020;38(Suppl 2):B8-B21. 10.1016/j.vaccine.2020.01.100.   25. ADVANCE. D5.7 Proof of Concept studies Phase 1: Results on near real-time monitoring. WP5 – Proof-of-concept studies of a framework to perform vaccine benefit-risk monitoring. Version 1.8 final.2019.
26. Emborg HD, Kahlert J, Braeye T, Bauwens J, Bollaerts K, Danieli G, et al. ADVANCE system testing: Can coverage of pertussis vaccination be estimated in European countries using electronic healthcare data-bases: an example. Vaccine 38(Suppl 2):B22-B30. 10.1016/j.vaccine.2019.07.039 2019.  27. Bollaerts K, Ledent E, de Smedt T, Weibel D, Emborg HD, Danieli G, et al. ADVANCE system testing: Benefit-risk analysis of a marketed vaccine using multi-criteria decision analysis and individual-level state transition modelling. Vaccine 2020;38(Suppl 2):B65-B75. 10.1016/j.vaccine.2019.09.034.   28. Weibel D, Dodd C, Mahaux O, Haguinet F, De Smedt T, Duarte-Salles T, et al. ADVANCE system testing: Can safety studies be conducted using electronic healthcare data? An example using pertussis vaccination. Vaccine 2020;38(Suppl 2):B38-B46. 10.1016/j.vaccine.2019.06.040.   29. Htar MTT, de Ridder M, Braeye T, Correa A, McGee C, de Lusignan S, et al. Advance system testing: Vaccine benefit studies using multi-country electronic health data – The example of pertussis vaccination. Vac-cine 2020;38(Suppl 2):B31-B37. 10.1016/j.vaccine.2019.08.078.  30. Bollaerts K, de Smedt T, McGee C, Emborg H, Villa M, Alexandridou M, et al. ADVANCE: Towards near real-time monitoring of vaccination coverage, benefits and risks using European electronic health record databases. Vaccine 2019;38(Suppl 2):B76-B83. 10.1016/j.vaccine.2019.08.012.   31. ADVANCE. D7.7 Blueprint of a framework to rapidly provide scientific evidence on post-marketing vaccination benefits and risks for informed decisions. WP7 – Implementability analysis. Version 2 final,.2018.
33. Avillach P, Mougin F, Joubert M, Thiessard F, Pariente A, Dufour JC, et al. A semantic approach for the homogeneous identification of events in eight patient databases: a contribution to the European eu-ADR project. Stud Health Technol Inform 2009;150:190-194. 10.3233/978-1-60750-044-5-190.  34. ADVANCE. D5.5 Ontology for the Integration and Extraction of Vaccine-related Information in Europe: a proof of concept. WP5 – Proof-of-concept studies of a framework to perform vaccine benefit-risk monitoring. Version 1.2017.
37. Petousis-Harris H. Assessing the safety of COVID-19 vaccines: a primer. Drug Saf 2020;43(12):1205-1210. 10.1007/s40264-020-01002-6.  
|
|














