만성 폐쇄성 폐질환의 동반상병분포와 사망에 영향을 미치는 요인
Abstract
Objectives
Chronic obstructive pulmonary disease (COPD) is a leading cause of death worldwide. This study aims to identify the rules associated with major comorbidities in patients with COPD and analyze how they affect death, thereby suggesting patient management measures that are efficient and can improve the quality of medical care.
Methods
For this purpose, among the Korea Disease Control and Prevention Agency's discharge injury in-depth survey data of more than 3 million cases from 2006 to 2021, adult patients aged 19 years or older with a principal diagnosis of chronic obstructive pulmonary disease were targeted. χ2-test and independent sample t-test were performed to analyze the distribution of deaths by demographic characteristics, and ARM (Association Rule Mining) was analyzed for association rules for comorbidities. Logistic regression analysis was performed on factors influencing death.
Results
As a result of the analysis, the mortality rate was high in patients over 75 years of age, patients admitted to the emergency room, and patients discharged from medical institutions with more than 1,000 beds. The prevalence of comorbidities was high for E11 (Type 2 diabetes mellitus) and I10 (essential hypertension). As a result of analyzing the impact on death based on major association rules, other sepsis (A41) and essential hypertension (I10), other sepsis (A41) and pneumonia, organism unspecified (J18), sequelae of tuberculosis (B90) and J96 (respiratory Failure, NEC), sequelae of tuberculosis (B90), and I27 (other pulmonary heart diseases) were found to have a high probability of death.
Conclusions
Based on the major association rules affecting death, we propose to apply them to a clinical decision support system for efficient patient management and personalized treatment.
Key words: Chronic obstructive pulmonary disease, Comorbidity, Association rule, Death factor, Personalized medicine
서 론
만성 폐쇄성 폐질환(chronic obstruction pulmonary disease, COPD)은 기침, 가래, 호흡곤란과 같은 지속적인 호흡기 증상과 더불어 폐의 기능이 점차 약화되는 질환이다[ 1]. 주로 흡연, 대기오염, 유전적 요인으로 인하여 만성적인 폐 실질의 염증이 발생하고 정상적인 상태로 회복하기 위한 복구기전이 억제되어 폐기종과 만성기관지염의 형태로 나타난다[ 1, 2]. COPD는 전 세계적으로 유병률과 사망률의 주요 원인으로 주목받고 있다[ 3]. 세계적으로 2019년에는 323만 명이 사망하여 사망원인 3위를 기록하였으며, 수명을 낮추는 등 건강을 해치는 7번째 주요 원인으로 세계보건기구에서는 비전염성 질병의 예방 및 통제를 위해 UN (United Nations) 2030 Agenda에 COPD를 포함하기에 이르렀다[ 2, 4]. 앞으로 우리나라를 비롯하여 전 세계적인 고령화 추세가 더해지면 COPD의 사망률과 질병부담은 지속적으로 증가할 것이다[ 5]. COPD 환자는 질병이 진행되는 동안에 다양한 질환이 함께 동반된다. 이로 인한 부정적인 영향은 환자의 삶의 질을 저하시키고 병원 입원과 사망률을 높인다[ 6]. 스페인의 한 연구에서 1개 이상의 동반질환이 있는 환자는 사망 위험이 두 배 이상 증가한다고 보고하였으며, 특히 경증 및 중증도 단계에서 COPD보다 동반질환으로 인한 사망위험이 더 높은 것으로 나타났다[ 7]. 미국의 한 연구에 따르면 50세 이하의 COPD 환자는 기류폐쇄가 없는 대조군에 비해 동반질환의 유병률과 사망위험이 높아서 동반질환에 의한 조기 위험을 경고하였다[ 8]. 특히 생존분석에서 나타난 동반질환 위험요인은 50세를 초과하는 환자와 다르게 나타났다. 이처럼 현재까지 시행된 COPD의 동반질환에 대한 연구는 몇 개의 단일 동반질환을 리뷰한 종설연구이거나, 단일 의료기관의 환자를 대상으로 한 제한적 연구가 주를 이루었다[ 9- 11]. 여러 다기관 임상연구[ 12, 13]를 시행하였더라도 국가를 대표할 수 있는 포괄적 연구는 찾아보기 어려웠다. 이러한 연구들은 연구대상과 규모, 시기의 차이로 인하여 동반질환의 규명이 각기 다르게 나타난다. 그동안 COPD의 동반질환 연구에서의 제한점을 극복하기 위해서 본 연구에서는 2가지 확장성을 고려하였다. 첫째는 국가의 대표성 있는 빅데이터를 이용하여 연구의 신뢰성과 타당성을 높이고, 둘째는 동반질환의 전통적인 방법인 문헌고찰, 빈도나 비율 등 단편적인 분석에서 탈피하여 연구결과의 일반화 수준을 향상시키는 것이다. 최근 보건의료분야에서 빅데이터(big data)를 기반으로 머신러닝(machine learning), 데이터마이닝(data mining)과 같은 분석기법이 시도되고 있다. 이 중 연관규칙마이닝(association rule mining, ARM)은 동반질환의 상호 연관관계를 분석하여 질병 간 패턴을 찾는데 유용한 분석방법이라고 판단하였다. 이것은 머신러닝의 비지도학습 중 하나로 분류분석이나 회귀분석과 달리 목표변수가 필요치 않으며 생성된 결과가 명확하여 질병 간 규칙을 직관적으로 이해하기가 쉬울 뿐만 아니라 의사결정을 지원하는데 용이하고 개인화된 서비스를 제공할 수 있다는 장점이 있다[ 14, 15]. 초기에는 마케팅에 활용할 목적으로 함께 구매한 품목의 패턴을 찾아서 향후 구매 가능성이 있는 상품을 추천하는데 활발히 응용되었다[ 16]. 최근 보건의료분야에도 질병예측, 성인의 복합상병 패턴 발견, 환자 불편감 감지 등 ARM을 활용한 다양한 연구들이 시도되고 있다[ 17- 19]. 이에 본 연구에서는 만성질환 관리를 위한 국가 빅데이터를 기반으로 ARM을 응용하여 COPD 환자의 다빈도 동반질환 분포를 확인하고 이들 동반질환 간 연관성에 어떠한 패턴이 나타나는지를 검증하고자 한다. 또한 사망에 영향을 미치는 주요 동반질환을 확인하여 만성 폐쇄성 폐질환 환자의 효율적 관리를 위한 시사점을 제공할 것이다. 나아가 이러한 만성질환에 대하여 병원의 디지털 컨버젼스(digital con-vergence) 전략으로 임상적 의사결정 지원시스템을 구축하는 등 개인별 맞춤치료와 환자관리에 활용할 수 있는 기반을 제공하고자 한다.
연구 방법
연구자료 및 대상
본 연구는 연구목적을 달성하기 위하여 퇴원손상심층조사 자료를 활용하였다. 퇴원손상심층조사는 만성질환 및 손상예방에 필요한 정책을 수립하고 평가하기 위한 국가승인통계로 의료기관 퇴원환자의 입원정보를 활용하여 매년 질병관리청에서 실시하는 표본조사 사업이다[ 20]. 모집단은 단과병원, 요양병원 등을 제외한 100병상 이상 일반병원에서 퇴원한 환자이다. 표본추출방법은 1차적으로 네이만배분법(Neyman allocation)에 의해 표본병원을 선정한 후 2단계로 표본병원의 퇴원환자 중 약 9%를 추출하는 2단계 층화이단집락 추출법이 적용되었으며, 조사항목에는 퇴원환자의 인구사회정보 외에도 내원정보와 질병 및 치료정보가 포함되어 있다[ 21, 22]. 특히 질병 및 치료정보는 한국표준질병사인분류와 국제의료행위분류를 사용하여 코드화되어있기 때문에 특정 질환을 대상으로 전국규모의 연구를 수행하기에 적합하다. 본 연구는 2006년부터 2021년까지 16년간 퇴원손상심층조사 자료 3,678,866명의 퇴원환자 중 주진단으로 COPD를 진단받은 19세 이상 성인환자 17,388명을 대상으로 하였다. COPD의 상병코드는 맥로드증후군(J43.0)을 제외한 J43(폐기종)과 J44(기타 만성 폐쇄성 폐질환)로 정의하였다[ 23].
분석변수
퇴원손상심층조사 자료 중 분석에 활용한 조사항목은 인구사회정보, 질병 및 치료정보, 내원정보이다. 인구사회정보에는 성별, 나이 그리고 진료비지불원을 연구에 활용하였다. 성별은 남자와 여자로 구분된 변수이며, 나이는 퇴원 시 환자의 만 나이가 적용되었다. 진료비지불원은 건강보험, 의료보호1종, 의료보호2종, 그리고 나머지는 기타로 분류하였다. 질병 및 치료정보에서 주진단코드 1개와 기타진단코드 20개 변수를 사용하였다. 이들 진단코드는 한국표준질병사인분류가 적용된 코드화된 변수이다. 주진단코드는 연구대상을 추출하는데 사용하였으며, 기타진단코드는 동반질환의 분포를 분석하기 위해 3단위 코드를 활용하였다. 또한 기타진단코드 존재여부에 따라 동반질환여부 변수를 생성하였다. 치료결과 변수를 이용하여 사망여부를 생성하였으며, 주수술코드 또는 기타수술코드가 있는 경우 수술한 것으로 구분하고 없는 경우 수술하지 않은 것으로 구분한 수술여부 변수를 생성하였다. 마지막으로 내원정보 중 입원경로는 외래, 응급, 기타로 구분하였으며, 환자가 치료받은 의료기관의 병상수는 100-299, 300-499, 500-999, 1,000병상 이상으로 구분하였다. 재원일수는 입원일과 퇴원일 변수를 이용하여 단입법으로 계산하였다.
분석방법
본 연구는 매년 20-30만 건 이상의 퇴원손상심층조사 자료를 병합하고 분석하기 위하여 R version 4.2.3을 이용하여 데이터베이스를 구축한 후 다음과 같이 분석하였다. COPD 환자의 성별, 연령 등 인구학적 특성에 따라서 사망의 분포와 사망률 차이를 분석하기 위하여 교차분석 및 독립표본 t-검정을 실시하였다. 연구대상자의 동반질환 분포는 유병률이 높은 순으로 막대그래프를 이용하여 시각화하였다. 여러 동반질환들 간에 어떤 연관성이 있는지 규명하기 위하여 ARM을 분석하였다. 분석에 이용한 프로그램인 R에서 연관성 규칙을 분석하기 위하여 Apriori 알고리즘이 적용된 arules 라이브러리를 이용하였다. Apriori는 빈발항목집합과 연관규칙을 분석하는데 활용되는 알고리즘으로 장바구니분석으로 알려져 있으며[ 24], 마케팅분야와 금융뿐만 아니라 최근 들어 보건의료분야에도 활용되고 있다[ 25- 27]. 주요 연관성 규칙의 지표에는 지지도, 신뢰도, 향상도를 사용하였다. 본 연구에서 support (A→ B)는 동반질환 A와 B가 전체 연구대상에서 발생하는 비율이며, Confidence (A→ B)는 동반질환 A를 진단받은 환자 중 동반질환 B를 함께 진단받은 환자의 비율을 뜻한다. 향상도는 중요한 연관규칙을 판단하는데 사용되는 지표이다. 본 연구에서 lift (A→ B)는 동반질환 A와 B가 독립적으로 발생하는 확률대비 함께 동반되는 확률의 비(ratio)를 계산한 것이다. 예를 들어 향상도가 2라는 것은 특정 동반질환 A와 B가 각각 발생할 확률에 비하여 함께 발생할 확률이 2배라는 의미이다. 따라서 의미 있는 연관규칙을 추출하기 위해서 향상도는 1을 초과해야 한다[ 28]. 본 연구에서 연관성 규칙의 강도는 지지도와 향상도를 고려한 interest support (IS)를 이용하였다. 이들 지표를 계산하기 위한 수식은 아래와 같다. 본 연구에서 연관성 규칙을 분석할 때 선행연구와 본 연구자료의 특성을 감안하여 지지도는 0.02 이상, 신뢰도는 0.1 이상의 기준을 적용하였다[ 29]. 전체 연구대상자와 사망, 생존환자를 각각 연관성 규칙을 분석하였으며 시각화를 위해 네트워크 그래프를 이용하였다. 마지막으로 앞서 만성 폐쇄성 폐질환 환자의 동반질환에 대한 주요 연관규칙 중 사망에 어떠한 영향을 미치는지 규명하였다. 이를 위해서 사망여부와 통계적으로 유의한 결과를 보인 일반적 특성 변수를 통제한 로지스틱 회귀분석을 실시하고 forest plot으로 시각화하였다.
연구 결과
연구대상자의 일반적 특성 및 사망 분포
연구대상자의 일반적인 특성에 따른 사망분포와 사망률을 분석한 결과 Table 1과 같다. 전체 연구대상자의 사망률은 4.2%이다. 성별에 따른 사망률은 통계적으로 유의하지 않았으나 연령은 사망한 환자가 75.7세로 생존환자 71.9세보다 유의하게 높았다( p <0.001). 연령군별로 분석한 결과 남성과 여성 모두 연령이 증가할수록 사망환자가 더 많았다. 특히 75세 이상 환자의 사망률은 5.3%로 전체 평균보다 높았다. 진료비지불원에 따라서는 건강보험환자가 전체 평균보다 높은 4.3%이었고 의료보호1종과 2종은 각각 3.8%와 3.1%로 다소 낮았다. 입원경로는 응급실의 경우 6.3%의 사망률을 보인 반면 외래를 통해 입원한 경우 2.2로 상대적으로 매우 낮았으며 통계적으로 유의하였다( p <0.001). 입원 중 수술한 환자의 사망률은 5.0%이었고 수술하지 않은 환자는 4.2%로 다소 차이가 있었으나 수술한 환자가 극히 적어 통계적으로 유의하지 않았다. 사망한 환자 중 동반질환을 진단받은 환자는 88.8%인 반면 사망하지 않은 환자의 동반질환 비율은 77.8%로 낮았으며 동반질환이 없는 환자보다 동반질환이 있는 환자의 사망률이 4배 높았다( p <0.001). 의료기관의 병상규모별로는 병상이 클수록 사망률이 증가하는 것으로 나타났으며 통계적으로 유의하였다( p <0.001). 재원일수는 사망환자의 경우 25.6일로 생존환자 11.8일에 비해 2배 이상 높았다( p <0.001).
Table 1
Demographic characteristics and mortality rate according to whether or not the study population died
|
Variables |
All patients |
Deceased |
Surviving |
Mortality (%) |
p-value |
|
Sex |
|
|
|
|
0.949 |
|
Male |
13,101 (75.3) |
552 (75.5) |
12,549 (75.3) |
4.2 |
|
|
Female |
4,287 (24.7) |
179 (24.5) |
4,108 (24.7) |
4.2 |
|
|
Age (y) |
72.1±10.8 |
75.7±9.8 |
71.9±10.9 |
|
<0.001 |
|
Age group |
|
|
|
|
<0.001 |
|
19-44 |
310 (1.8) |
5 (0.7) |
305 (1.8) |
1.6 |
|
|
45-64 |
3,359 (19.3) |
79 (10.8) |
3,280 (19.7) |
2.4 |
|
|
65-74 |
5,582 (32.1) |
212 (29.0) |
5,370 (32.2) |
3.8 |
|
|
≥75 |
8,137 (46.8) |
435 (59.5) |
7,702 (46.2) |
5.3 |
|
|
Insurance type |
|
|
|
|
0.473 |
|
National health |
13,554 (78.0) |
586 (80.2) |
12,968 (77.9) |
4.3 |
|
|
Medicaid I |
3,287 (18.9) |
126 (17.2) |
3,161 (19.0) |
3.8 |
|
|
Medicaid II |
288 (1.7) |
9 (1.2) |
279 (1.7) |
3.1 |
|
|
Others |
259 (1.5) |
10 (1.4) |
249 (1.5) |
3.9 |
|
|
Admission route |
|
|
|
|
<0.001 |
|
Outpatient |
8,906 (51.2) |
194 (26.5) |
8,712 (52.3) |
2.2 |
|
|
Emergency |
8,474 (48.7) |
537 (73.5) |
7,937 (47.6) |
6.3 |
|
|
Others |
8 (0.0) |
0 (0.0) |
8 (0.0) |
0.0 |
|
|
Operation |
|
|
|
|
0.530 |
|
Yes |
360 (2.1) |
18 (2.5) |
342 (2.1) |
5.0 |
|
|
No |
17,028 (97.9) |
713 (97.5) |
16,315 (97.9) |
4.2 |
|
|
Comorbidity |
|
|
|
|
<0.001 |
|
Yes |
13,608 (78.3) |
649 (88.8) |
12,959 (77.8) |
4.8 |
|
|
No |
3,780 (21.7) |
82 (11.2) |
3,698 (22.2) |
2.2 |
|
|
Bed size |
|
|
|
|
<0.001 |
|
100-299 |
6,371 (36.6) |
214 (29.3) |
6,157 (37.0) |
3.4 |
|
|
300-499 |
2,559 (14.7) |
107 (14.6) |
2,452 (14.7) |
4.2 |
|
|
500-999 |
6,824 (39.2) |
318 (43.5) |
6,506 (39.1) |
4.7 |
|
|
≥1,000 |
1,634 (9.4) |
92 (12.6) |
1,542 (9.3) |
5.6 |
|
|
Length of stay (day) |
12.4±18.1 |
25.6±38.0 |
11.8±17.2 |
|
<0.001 |
|
Total |
17,388 (100.0) |
731 (100.0) |
16,657 (100.0) |
4.4 |
|
동반질환 분포
COPD 환자의 다빈도 동반질환을 시각화한 결과 Figure 1과 같다. 가장 많이 나타나는 동반질환은 본태성 고혈압(I10)이었다. 연구대상자 4명 중 1명은 고혈압을 진단받은 것으로 분석되었다. 다음으로 상세불명의 병원체의 폐렴(J18)이 동반된 환자가 20% 이상이었다. 2형 당뇨병(E11)과 결핵의 후유증(B90)이 동반된 환자는 10%가 넘었으며, 전립선비대증(N40), 심부전(I50), 상세불명의 당뇨병(E14), 위염 및 십이지장염(K29), 기관지확장증(J47), 심방세동 및 조동(I48), 위-식도 역류병(K21)이 동반된 환자는 5% 이상이었다. 나머지는 5% 미만이었다. 사망환자의 동반질환 분포는 다른 양상을 나타냈다. 상세불명 병원체의 폐렴(J18)이 가장 많이 동반되었고, 다음으로 본태성 고혈압(I10), 결핵의 후유증(B90), 2형 당뇨병(E11), 심부전(I50) 등이었다.
Figure 1
Common comorbidities of COPD. (A) All patients, (B) Deceased, (C) Surviving. COPD, chronic obstructive pulmonary disease; A16, Respiratory tuberculosis, not confirmed bacteriologically or histologically; A41, Other sepsis; B90, Sequelae of tuberculosis; E11, Type 2 diabetes mellitus; E14, Unspecified diabetes mellitus; E78, Disorders of lipoprotein metabo-lism and other lipidaemias; I10, Essential (primary) hypertension; I20, Angi-na pectoris; I25, Chronic ischaemic heart disease; I26, Respiratory tuberculosis, not confirmed bacteriologically or histologically; I27, Other pulmonary heart diseases; I48, Atrial fibrillation and flutter; I50, Heart failure; I69, Sequelae of cerebrovascular disease; J15, Bacterial pneumonia, NEC; J18, Pneumonia, organism unspecified; J44, Other chronic obstructive pulmonary disease; J47, Bronchiectasis; J90, Pleural effusion, NEC; J93, Pneumo-thorax; J96, Respiratory failure, NEC; J98, Other respiratory disorders; K21, Gastrooesophageal reflux disease; K29, Gastritis and duodenitis; K59, Other functional intestinal disorders; L89, Decubitus ulcer and pressure area; M81, Osteoporosis without pathological fracture; N17, Acute renal failure; N18, Chronic kidney disease; N40, Hyperplasia of prostate. 
동반질환 간 연관성 규칙
만성 폐쇄성 폐질환 환자의 동반질환의 연관성 규칙을 분석한 결과 Table 2와 같다. 향상도가 1을 초과하는 연관규칙은 전체환자를 대상으로 분석하였을 때 4개가 나타났고, 사망환자는 16개, 생존환자는 3개였다. 연관성의 강도를 나타내는 지표인 IS가 큰 순서로 정렬하여 제시하였다. 전체환자를 대상으로 분석한 결과 연관성의 강도가 가장 높은 동반질환 규칙은 “ E11→ I10”이었다(lift=1.804, IS=0.305). 이것은 2형 당뇨병(E11)과 본태성 고혈압(I10)이 독립적으로 발생할 확률대비 함께 동반될 확률이 1.804배라는 의미이다. 다음은 “ E14→ I10”으로 상세불명의 당뇨병(E14)과 본태성 고혈압(I10)이 독립적으로 발생하는 확률에 비하여 함께 동반될 확률이 1.760배로 분석되었다. 본태성 고혈압(I10)과 전립선비대증(N40)도 주요한 연관규칙으로 발견되었는데, 앞선 연관규칙보다 다소 낮은 1.266의 향상도를 보였다.
Table 2
Comorbidity association rules for COPD
|
No |
Rules |
n |
Support |
Confidence |
Lift |
IS |
|
Whole study population |
|
|
|
|
|
|
|
1 |
E11→ I10 |
700 |
0.051 |
0.464 |
1.804 |
0.305 |
|
2 |
E14→ I10 |
351 |
0.026 |
0.453 |
1.760 |
0.213 |
|
3 |
I10→ N40 |
402 |
0.030 |
0.115 |
1.266 |
0.193 |
|
4 |
B90→ J18 |
309 |
0.023 |
0.220 |
1.014 |
0.152 |
|
Deceased patient |
|
|
|
|
|
|
|
1 |
E11→ I10 |
38 |
0.059 |
0.475 |
2.015 |
0.343 |
|
2 |
I10→ J18 |
56 |
0.086 |
0.366 |
1.024 |
0.297 |
|
3 |
I48→ I50 |
17 |
0.026 |
0.274 |
2.542 |
0.258 |
|
4 |
B90→ J18 |
35 |
0.054 |
0.412 |
1.152 |
0.249 |
|
5 |
J44→ J18 |
21 |
0.032 |
0.677 |
1.895 |
0.248 |
|
6 |
E14→ I10 |
19 |
0.029 |
0.463 |
1.966 |
0.240 |
|
7 |
A41→ J18 |
23 |
0.035 |
0.561 |
1.569 |
0.236 |
|
8 |
B90→ I27 |
16 |
0.025 |
0.188 |
2.182 |
0.232 |
|
9 |
B90→ J96 |
14 |
0.022 |
0.165 |
2.375 |
0.226 |
|
10 |
I10→ I48 |
22 |
0.034 |
0.144 |
1.505 |
0.226 |
|
11 |
N18→ I10 |
13 |
0.020 |
0.565 |
2.398 |
0.219 |
|
12 |
E11, J18→ I10 |
13 |
0.020 |
0.565 |
2.398 |
0.219 |
|
13 |
I10→ N40 |
17 |
0.026 |
0.111 |
1.803 |
0.217 |
|
14 |
L89→ I10 |
13 |
0.020 |
0.361 |
1.532 |
0.175 |
|
15 |
N17→ J18 |
18 |
0.028 |
0.360 |
1.007 |
0.167 |
|
16 |
A41→ I10 |
13 |
0.020 |
0.317 |
1.345 |
0.164 |
|
Survived patient |
|
|
|
|
|
|
|
1 |
E11→ I10 |
662 |
0.051 |
0.464 |
1.794 |
0.303 |
|
2 |
E14→ I10 |
332 |
0.026 |
0.452 |
1.751 |
0.212 |
|
3 |
I10→ N40 |
385 |
0.030 |
0.115 |
1.248 |
0.192 |
사망환자의 경우에도 “ E11→ I10”이 가장 높은 연관관계로 나타났다(lift=2.015, IS=0.343). 다음은 “ I10→ J18”로 본태성 고혈압(I10)과 상세불명의 병원체 폐렴의 연관규칙이었다(lift=1.024, IS=0.297). 향상도가 1.024로 아래에 있는 연관규칙보다 높지 않지만 지지도를 고려한 IS를 계산한 결과 사망환자에서 두 번째로 주요한 연관규칙으로 분석되었다. 다음은 순환기계통의 질환인 심방세동 및 조동(I48)과 심부전(I50) 간의 연관규칙인 “ I48→ I50”이었다(lift=2.542, IS=0.258). 이들 동반질환이 각각 발생할 확률대비 함께 동반될 확률이 2.542배에 이른다. 다음으로 강도가 높은 연관규칙은 결핵의 후유증(B90)과 상세불명 병원체의 폐렴(J18) 간의 연관규칙인 “ B90→ J18”이었다(lift=1.152, IS=0.249). 다섯번째로 높은 연관관계는 “ J44→ J18”로 나타났다(lift=1.895, IS=0.248). 사망환자에서는 16개 연관규칙 중 본태성 고혈압(I10)과 관련한 연관규칙이 9개로 가장 많았고, 상세불명 병원체의 폐렴(J18) 6개, 결핵의 후유증(B90) 3개, 기타 폐혈증(A41), 2형 당뇨병(E11), 심방세동 및 조동(I48)과 관련된 것은 각각 2개로 나타났다. 생존환자의 연관규칙은 전체환자를 대상으로 분석한 결과와 크게 다르지 않았다.
앞서 분석한 각각의 대상별로 연관규칙을 네트워크 그래프로 시각화한 결과 Figure 2와 같다. 전체환자와 생존환자의 네트워크 그래프는 본태성 고혈압(I10)을 중심으로 형성된 단순한 형태를 보였으나 사망환자의 경우 본태성 고혈압(I10)과 2형 당뇨병(E11), 상세불명 병원체의 폐렴(J18) 그리고 결핵의 후유증(B90)을 중심으로 주변의 다양한 동반질환이 형성되는 것으로 나타났다.
Figure 2
Network graph for association rule of comorbidity in COPD. (A) Whole study population. (B) Deceased patient. (C) Survived patient. COPD, chronic obstructive pulmonary disease. 
사망의 영향요인
COPD의 동반질환 연관규칙이 사망에 미치는 영향을 분석하고자 로지스틱 회귀분석을 실시한 후 Forest plot으로 시각화하였다( Figure 3). 연구대상자의 인구학적 특성 중 성별과 연령 외에 사망여부와 유의한 관련성을 보이는 변수는 통제한 상태에서 동반질환 연관규칙의 영향력을 odds ratio (OR)를 이용하여 분석하였다. 분석결과 기타 폐혈증(A41)과 본태성 고혈압(I10)이 동반될 경우 18배 이상의 사망확률로 가장 높았다(OR=18.385, p <0.001). 다음은 폐혈증(A41)과 상세불명 병원체의 폐렴(J18)이 동반되는 경우 사망확률이 높았다(OR=10.490, p < 0.001). 결핵의 후유증(B90)과 달리 분류되지 않은 호흡부전(J96)이 동반될 경우 7배 이상 사망할 확률이 높았으며(OR=7.835, p <0.001), 욕창궤양 및 압박부위(L89)와 본태성 고혈압(I10)의 동반이 뒤를 따랐다(OR=5.707, p <0.001). 이외에도 급성 신부전(N17)과 상세불명 병원체의 폐렴(J18), 결핵의 후유증(B90)과 기타 폐성 심장질환(I27), 기타 만성 폐쇄성 폐질환(J44)과 상세불명 병원체의 폐렴(J18)이 동반될 경우 사망확률이 유의하게 높았다(OR=1.533, p <0.001).
Figure 3
Forest plot for association rule of comorbidities affecting death in COPD. COPD, chronic obstructive pulmonary disease. 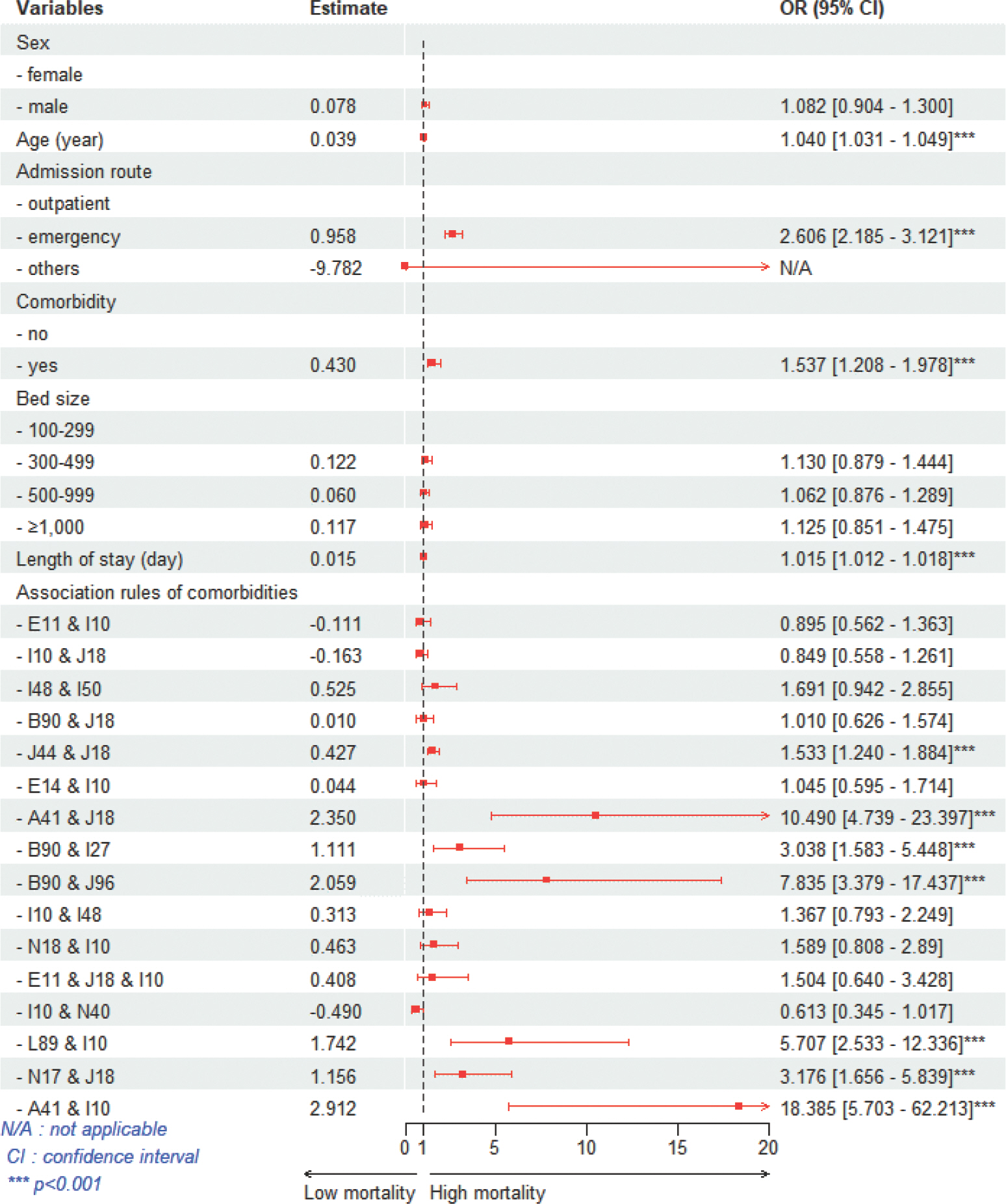
고찰 및 결론
COPD는 폐 기능의 점진적인 악화와 정신적, 육체적 동반질환이 따르는 등 질병부담이 높아 세계적으로 주목하는 질환 중 하나이다. 흡연이 주요 원인이며 개발도상국에서 심각한 이환율과 사망률로 질병부담이 선진국보다 크다. 향후 고령화가 증가함으로 인해서 과도한 의료자원의 소모와 의료비 지출이 증가할 것으로 전망된다. 본 연구는 국가기반의 빅데이터를 바탕으로 그동안 전통적인 연구방법을 극복하여 만성 폐쇄성 폐질환 환자의 효과적인 관리와 개인별 맞춤치료에 활용할 목적으로 시도되었다. 구체적으로 동반질환의 유병률과 패턴을 규명하고 사망에 영향을 미치는 동반질환을 밝히는 것이다.
주요 연구결과를 바탕으로 고찰한 결과 다음과 같다. COPD 환자의 병원입원 사망률은 4.2%로 분석되었다. 성별 사망률은 각각 4.2%로 차이가 없었으나 환자 수는 남성이 여성보다 3배이상 많은 것으로 나타났다. 국내외 모두 남성의 비율이 높았으나 덴마크와 같이 여성의 흡연 비율이 높은 국가에서는 여성이 절반을 넘는 경우도 있었다[ 30]. COPD의 주된 원인이 흡연이며 여성보다 남성이 흡연율이 높기 때문에 발생한 것으로 판단된다[ 31, 32]. 국제적인 다기관 코호트 자료를 이용한 COPD의 성별 차이 연구결과에 따르면 남성이 68.8%로 여성 31.2%에 비하여 2배 이상 많았고, 흡연의 양과 기간을 지표화한 Pack-year index도 남성이 47.8로 여성 33.3보다 높아[ 33] 본 연구와 크게 다르지 않았다. 병원에 입원한 COPD 환자의 평균연령은 생존환자 71.9세에 비해 사망환자는 75.7세로 다소 높았다. COPD 환자의 재입원에 관한 메타분석을 시행한 연구에서 평균연령은 국가와 연구시기에 따라 다소 차이가 있었으나 최소 65에서 최대 74세였다[ 34]. 본 연구는 72.1세로 이 범위에 포함되는 수치를 나타낸다. 연령별 분포는 연령이 증가할수록 COPD 환자가 증가하여 75세 이상 연령군에서 가장 높은 분포를 보였으며, 사망률도 연령에 비례하였다. 이러한 연구결과는 국내와 국외 연구에서 모두 같은 추세를 보였다[ 35, 36]. 주진단인 COPD 외에 1개 이상 동반질환을 진단받은 환자는 78.3% 수준이었으며, 사망환자는 생존환자에 비해 10% 포인트 높은 88.8%로 유의한 차이가 있었다. 덴마크의 2010-2021년 전국적인 인구 기반 코호트 연구에 의하면 COPD 환자의 동반질환 유병률은 78.6%로 본 연구와 같은 수준이었다[ 30]. 이것은 일반환자의 동반질환 유병률 54.6%에 비해서도 24.0%나 높다. 따라서 COPD 환자의 동반질환 관리가 필요함을 시사한다. 재원일수는 평균 12.4일이며 사망한 환자가 25.6일로 생존환자 11.8일에 비해 2배 이상 길었다. 폴란드의 국가기반 데이터를 분석한 연구에서 COPD 환자의 평균 재원일수는 9.4일로 본 연구와 차이가 있었다[ 37]. 본 연구는 COPD가 주진단인 환자를 대상으로 하였고, 이 연구에서는 주진단 외에 기타진단인 환자도 연구대상에 포함된 결과로 판단된다. 종합하면 본 연구는 COPD로 병원입원한 환자를 대상으로 시행한 국제적인 연구결과와 비슷한 수준이었다. COPD는 환자의 평균 연령이 높고 흡연이 주된 원인이기 때문에 다양한 동반질환에 이환될 수 있다. 지금까지 COPD의 동발질환은 고혈압, 당뇨병, 결핵, 심뇌혈관질환, 우울증을 포함한 정신질환 등 다양하며 동반질환의 수가 많을수록 사망률이 현저히 증가하는 것으로 알려져 있다[ 38- 40]. 본 연구결과 사망을 포함한 전체 분석대상자와 생존환자는 크게 다르지 않았다. 주요 동반질환은 고혈압과 폐렴이 20% 이상으로 가장 높았으며, 2형 당뇨병과 결핵의 후유증이 10% 이상 동반하는 것으로 나타났다. 하지만 사망환자의 동반질환 분포는 폐렴이 35% 이상으로 가장 높았고, 다음으로 고혈압, 결핵의 후유증, 2형 당뇨병, 심부전 순으로 높게 나타나 차이를 보였다. 특히 사망환자는 폐렴, 심부전, 기타 폐성 심장질환, 급성 신부전 등이 동반되는 비율이 상승하는 것으로 나타났다. 튀르키예의 일개 대학병원에 입원한 COPD 환자 연구에서는 동반질환의 유병률이 84.5%에 달했으며, 주요 동반질환으로 고혈압(29.5%), 심부전(29.5%), 당뇨병(20.9%)으로 나타났다. 연구대상자의 전반적인 동반질환 유병률은 본 연구보다 높았으나 고혈압과 당뇨병에 대한 유병률은 본 연구와 비슷한 수준이었다[ 41]. 국가등록 데이터를 이용한 국외 연구를 살펴보면 고혈압 28.6%, 심부전 27.0%, 당뇨병 10.9%, 만성 신부전 3.4% 등이 동반되어 본 연구와 비슷한 수준이었다[ 37]. 그러나 본 연구에서 주요 동반질환에 포함되지 않은 폐암이 8.8%로 나타난 것은 차이가 있었다. 이는 폐암의 주된 원인이 흡연인 것은 COPD와 동일하지만 국가마다 대기오염의 차이 등 다양한 요인에 의한 결과로 보여진다. 일반 인구에 비해 COPD 환자의 폐암발생률이 4배 이상 높고 폐기능 손상에 더욱 심각한 문제를 일으키기 때문에 유의할 필요가 있다[ 11]. 따라서 향후 폐암과 COPD의 동반질환 연구를 제안한다. COPD 환자의 동반질환 수가 증가하면 생존에 부정적인 영향을 미치기 때문에 사망률을 줄이는데 동반질환의 평가와 치료가 모두 중요하다[ 41]. 이에 본 연구는 기존 COPD 환자의 동반질환 연구와 차별화를 위해 동반질환 간 연관규칙을 심층분석하고 이를 바탕으로 사망에 미치는 영향을 규명하였다. 가장 높은 연관성을 가지는 질환은 2형 당뇨병과 고혈압이다. 전체 연구대상자와 생존환자의 동반질환 연관규칙은 다르지 않았으나, 사망환자는 다양한 규칙이 생성되었다. 이 중 특이한 사항은 고혈압을 중심으로 사망환자에서 다빈도 동반질환이었던 폐렴, 심방세동 및 조동, 만성 신장병, 전립선 증식증, 욕창, 패혈증이 연관관계를 형성한 것이다. 동반질환의 연관규칙 강도가 크다고 해서 반드시 사망확률이 높은 것은 아니다. 따라서 본 연구에서는 이러한 연관규칙이 사망에 미치는 영향을 분석한 결과 패혈증과 고혈압, 폐혈증과 폐렴, 결핵의 후유증과 호흡부전, 욕창과 고혈압, 급성 신부전과 폐렴, 결핵의 후유증과 기타 폐성 심장질환이 함께 동반될 때 사망할 확률이 높은 것으로 밝혀졌다. 선행연구에서 심부전, 심방세동, 당뇨병[ 42], 심혈관 질환과 만성 신부전[ 43, 44], 폐렴[ 45]이 동반될 때 사망률이 높았다. 분석방법 및 질병의 분류방법 등의 차이로 일부 동반질환은 본 연구를 지지하였고 당뇨병과 같은 질환은 다른 결과를 보였다. 본 연구에서 당뇨병과 고혈압의 연관규칙의 강도가 가장 높았지만 사망에는 유의한 영향을 미치지 않았다. 다만 고혈압은 욕창과 패혈증이 동반할 때 사망할 확률이 높았다. COPD가 진단되기 전에 기저 질환으로 고혈압이나 당뇨병을 보유한 환자는 악화되지 않도록 관리하여야 하며, COPD 진단 이후에는 당뇨병과 고혈압이 이환되지 않도록 관리하여 사망에 영향을 미치는 다양한 동반질환과의 연결고리를 차단하여야 한다. 본 연구는 사망에 영향을 미치는 단편적인 동반질환을 분석한 기존 연구와는 달리 연관규칙을 통해 주요 사망에 영향을 미치는 동반질환의 특성을 심층분석한 데 의의가 있다. 이러한 연구결과를 환자관리와 임상의사결정지원시스템에 적용한다면 개인형 맞춤치료를 통해서 의료의 질을 높일 수 있을 것이다. 본 연구는 국가단위의 대용량 빅데이터를 이용하고 전통적인 분석방법을 극복하는 등 연구의 타당성과 신뢰성을 높이는 노력에도 불구하고 몇 가지 제한점을 가진다. 첫째, 본 연구에 활용한 퇴원손상심층조사는 전국단위의 국가조사 사업임에도 불구하고 자료취득의 효율성을 위해 100병상 미만의 의료기관이 표본병원에서 제외된 자료이므로 일반화에 주의할 필요가 있다. 둘째, 동반질환이 발생하는 시간적 선후관계를 밝히기 위해서는 시차연관규칙을 분석할 필요가 있다. 하지만 본 연구에 사용된 자료는 특정 표본환자를 대상으로 추적관찰이 아닌 입원발생에 따른 단면조사 자료이므로 시차연관규칙을 적용할 수 없었다. 이를 극복하기 위해서는 다양한 질환의 동반질환 코호트 구축을 통하여 표본병원을 확대하고 추적관찰이 필요하다. 마지막으로 동반질환의 발생빈도를 고려한 알고리즘 적용을 제안한다.
지금까지 본 연구결과의 고찰을 통해서 COPD 환자의 동반질환 패턴을 규명할 뿐만 아니라 어떤 질환들이 함께 공존할 때 사망할 확률이 높은지를 밝히고 임상적 타당성을 검토하였다. 특히 사망환자를 대상으로 한 동반질환의 패턴에는 고혈압, 당뇨병을 비롯하여 결핵의 후유증, 폐성 심장질환, 심방세동 및 조동, 심부전 등이 관여하는 것으로 나타났다. 연관규칙 강도와 사망에 유의한 영향을 미치는 동반질환 패턴이 반드시 일치하는 것은 아니므로 단계적인 환자관리에 유의할 필요성이 있다. 즉 COPD 환자가 특정 질환이 동반될 때 이후 어떤 질환이 진단될 가능성이 높은지 관리하여 이를 사전에 예방하여야 한다. 그리고 이러한 동반질환이 사망에 미치는 영향을 판단하여 사망률을 낮추는 노력이 필요하다. 앞으로 질병부담이 높은 질환에 대하여 이러한 분석방법을 확대하고 임상의사결정시스템에 주요 규칙으로 적용하여 체계적인 환자관리를 시행할 것을 제언한다.
REFERENCES
1. Vogelmeier CF, Román-Rodríguez M, Singh D, Han MK, Rodríguez-Roisin R, Ferguson GT. Goals of COPD treatment: Focus on symptoms and exacerbations. Respir Med 2020;166:105938. DOI: 10.1016/j.rmed. 2020.105938.   2. Weir DL, Bai YQ, Thavorn K, Guilcher S, Kanji S, Mulpuru S, et al. Non-adherence to COPD medications and its association with adverse events: A longitudinal population based cohort study of older adults. Ann Epidemiol. 2023;S1047-2797(23)00228-4. DOI: 10.1016/j.annepi-dem.2023.12.003.   3. Agustí A, Vogelmeier C, Faner R. COPD 2020: Changes and challeng-es. Am J Physiol Lung Cell Mol Physiol 2020;319(5):L879-L883. DOI: 10.1152/ajplung.00429.2020.   7. Recio Iglesias J, Díez-Manglano J, López García F, Díaz Peromingo JA, Almagro P, Varela Aguilar JM. Management of the COPD Patient with Comorbidities: An Experts Recommendation Document. Int J Chron Obstruct Pulmon Dis 2020;15:1015-1037. DOI: 10.2147/COPD.S242009.   9. Barnes PJ. Senescence in COPD and its comorbidities. Annu Rev Physiol 2017;79:517-539. DOI: 10.1146/annurev-physiol-022516-034314.   10. Negewo NA, Gibson PG, McDonald VM. COPD and its comorbidities: Impact, measurement and mechanisms. Respirology 2015;20(8):1160-1171. DOI: 10.1111/resp.12642.   13. Divo M, Cote C, Torres JPd, Casanova C, Marin JM, Pinto-Plata V, et al. Comorbidities and risk of mortality in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012;186(2):155-161. DOI: 10.1164/rccm.201201-0034OC.  14. Hruschka H. Comparing unsupervised probabilistic machine learning methods for market basket analysis. Rev Manag Sci 2021;15:497-527. DOI: 10.1007/s11846-019-00349-0.   15. Ambika M, Raghuraman G, SaiRamesh L. Enhanced decision support system to predict and prevent hypertension using computational intelligence techniques. Soft Comput 2020;24:13293-13304. DOI: 10.1007/s00500-020-04743-9.   16. Rao AB, Kiran JS, G P. Application of market–basket analysis on healthcare. Int J Syst Assur Eng Manag 2023;14(Suppl 4):924-929. DOI: 10. 1007/s13198-021-01298-2.   18. Ramasamy S, Nirmala K. Disease prediction in data mining using association rule mining and keyword based clustering algorithms. Int J Comput Appl 2020;42(1):1-8. DOI: 10.1080/1206212X.2017.1396415.  19. Ahmed I, Jeon G, Piccialli F. A deep-learning-based smart healthcare system for patient's discomfort detection at the edge of internet of things. IEEE Internet Things J 2021;8(13):10318-10326. DOI: 10.1109/JIOT. 2021.3052067.  20. Korea Disease Control and Prevention Agency. Korean National Hospital Discharge In-depth Injury Survey guidebook. Cheongju: Korea Disease Control and Prevention Agency; 2016. (Korean).
23. Lim H, Park M. Analysis of treatment pattern in COPD patients using Health Insurance Claims Data: Focusing on inhaled medications. Korean J Clin Pharm 2022;32(3):155-165. (Korean). DOI: 10.24304/kjcp.2022.32.3.155.  24. Ünvan YA. Market basket analysis with association rules. Communi-cations in Statistics-Theory and Methods 2021;50(7):1615-1628. DOI: 10.1080/03610926.2020.1716255.  25. Sornalakshmi M, Balamurali S, Venkatesulu M, Navaneetha Krishnan M, Ramasamy LK, Kadry S, et al. RETRACTED ARTICLE: Hybrid method for mining rules based on enhanced Apriori algorithm with sequential minimal optimization in healthcare industry. Neural Comput Applic 2022;34:10597-10610. DOI: 10.1007/s00521-020-04862-2.   28. Zeng N, Xiao H. Inferring implications in semantic maps via the Apriori algorithm. Lingua 2020;239:102808. DOI: 10.1016/j.lingua.2020. 102808.  33. Perez TA, Castillo EG, Ancochea J, Pastor Sanz MT, Almagro P, Mar-tínez-Camblor P, et al. Sex differences between women and men with COPD: A new analysis of the 3CIA study. Respir Med 2020;171:106105. DOI: 10.1016/j.rmed.2020.106105.   34. Njoku CM, Alqahtani JS, Wimmer BC, Peterson GM, Kinsman L, Hurst JR, et al. Risk factors and associated outcomes of hospital read-mission in COPD: A systematic review. Respir Med 2020;173:105988. DOI: 10.1016/j.rmed.2020.105988.   35. Park SC, Kim DW, Park EC, Shin CS, Rhee CK, Kang YA, et al. Mortality of patients with chronic obstructive pulmonary disease: A nation-wide populationbased cohort study. Korean J Intern Med 2019;34(6):1272-1278. (Korean). DOI: 10.3904/kjim.2017.428.   36. Lortet-Tieulent J, Soerjomataram I, López-Campos JL, Ancochea J, Coebergh JW, Soriano JB. International trends in COPD mortality, 1995-2017. Eur Respir J 2019;54(6):1901791. DOI: 10.1183/13993003. 01791-2019.  43. Aramburu A, Arostegui I, Moraza J, Barrio I, Aburto M, García-Loizaga A, et al. COPD classification models and mortality prediction capacity. Int J Chron Obstruct Pulmon Dis 2019;14:605-613. DOI: 10.2147/COPD.S184695.   45. Hespanhol V, Bárbara C. Pneumonia mortality, comorbidities matter? Pulmonology 2020;26(3):123-129. DOI: 10.1016/j.pulmoe.2019.10.003.  
|
|














