한국 성인의 대사 위험인자 패턴 및 영양상태와 심뇌혈관질환 또는 지방간 발생 위험률: 전향적 코호트 연구
Cardiocerebrovascular Disease or Fatty Liver Incidence Associated with Pattern of Metabolic Risk Factors and Nutritional Status of Korean Adults: A Prospective Cohort Study
Article information
Trans Abstract
Objectives
To determine the nutrient intake according to patterns of metabolic risk factors, and examine the relationship between patterns of metabolic risk factors and incidence of cardiocerebrovascular disease or fatty liver in Korean adults.
Methods
Data from the Korean Genome and Epidemiology Study were used to analyze 7,019 adults aged 50-64 years old. Depending on patterns of metabolic risk factors, participants were classified into four categories: ‘normal, NOR’, ‘obesity risk factors, ORF’, ‘vascular risk factors, VRF’, ‘cluster risk factors, CRF’. Cox regression analysis was used to evaluate the incidence of cardiocerebrovascular disease or fatty liver.
Results
The mean adequacy ratio (MAR) of VRF pattern women was significantly lower than that of the normal women. In Model 3, the incidence of cardiovascular disease or fatty liver decreased by 64.4% (hazard ratio (HR), 0.36; 95% confidence interval (CI), 0.15-0.84) in MAR Q3 women compared to MAR Q1 women. In Model 2 adjusted for age and energy intake, the incidence of cardiovascular disease or fatty liver increased by 87.6% (HR, 1.88; 95% CI, 1.01-3.48) in CRF pattern women compared to NOR women, but there was no significant difference in Model 3.
Conclusions
The study showed that among women, VRF patterns were associated with poor nutrient intake. There was an association between nutrient intake levels and metabolic risk factor patterns in women. Therefore, these findings can be used a basis to emphasize the need to establish nutrition management strategies tailored to individual's metabolic risk status, for the prevention and management of metabolic syndrome complications.
서 론
전 세계적으로 기대수명이 증가하고, 연령과 함께 질병의 유병률도 증가하여, 질병의 경향에 따른 보건의료 시스템의 변화가 요구되고 있다[1]. 2021년도 우리나라 대사증후군 유병률은 21.3% (남성 24.1%, 여성 18.4%)로 남성이 높았고, 연령 증가에 따라 유병률이 증가하여 30대 9.2% (남성 14.0%, 여성 2.6%), 40대 17.6% (남성 24.7%, 여성 9.2%), 50대 22.0% (남성 26.7%, 여성 17.3%), 60대 35.0% (남성 34.8%, 여성 35.2%), 70대 42.7% (남성 36.8%, 여성 47.9%), 80대 이상 45.5% (남성 37.8%, 여성 51.6%)로 발표되었다[2]. 유병률은 성별에 따라 차이가 나타나 50대까지는 남성이 여성보다 높았으나 60대 이후에는 여성이 남성보다 높게 나타남으로써, 완경 이후 여성의 대사증후군 예방을 위한 특별한 관리가 필요한 것으로 여겨진다[3]. 대사증후군 유병률은 우리나라 뿐 아니라 전 세계적으로 증가 추세에 있으며, 세계 유병률은 세계인구의 약 1/4 정도로 10억 명 이상의 세계인이 대사증후군에 노출된 것으로 추정한다[4]. 대사증후군 유병률 증가가 문제가 되는 이유 중 하나는 대사 위험인자의 복합적 대사이상은 다른 질환과 연계되어 심뇌혈관질환, 지방간, 악성종양 등의 발생률과 이로 인한 사망률이 증가된다는 점이다[5,6]. Lakka et al. [7]은 심혈관질환(cardiovascular disease, CVD), 당뇨병 등 기저질환이 없는 사람을 대상으로 진행한 코호트 연구에서 대사증후군 발생 남성은 대사증후군이 없는 남성에 비해 CVD 발생률과 사망률이 증가하였고, 미국 성인 대상의 심뇌혈관질환 관련 연구에서도 대사증후군이 있는 환자는 대사증후군이 없는 환자보다 관상동맥 심장질환(coronary heart disease, CHD)와 CVD 발생률 및 사망률이 유의하게 높았다[8]. 복합적 대사이상으로 지방간과 연계된 연구를 보면, 복부비만, 높은 혈당은 인슐린 저항성을 유발하여 간세포에 과도한 지방을 축적하고, 염증을 일으켜 비알코올성 지방간염(non-al-coholic steatohepatitis, NASH) 발생 증가를 유도하였고[9], 지방간으로 인해 간의 염증 조절 기능 제한되면 혈관 손상과 혈전 형성이 증가하여 심뇌혈관질환의 발생 및 사망률이 증가한다고 보고하였다[6,10]. 40-70세 한국인을 대상으로 metabolic dysfunction-associated fatty liver disease (MAFLD)와 CVD 발생률 연구[11]에서 MAFLD는 전체 사망률을 증가시켰으며, MAFLD가 있는 Type 2 당뇨환자는 CVD 발병 위험이 42% 증가하여, 대사 위험인자의 복합적 대사이상이 심뇌혈관질환 또는 지방간의 발생 증가와 연관되어 있음이 확인되었다. 이 외 대사증후군 극복을 위해 진행된 연구에서, 대사증후군의 여러 요인이 사회인구학적 특성, 건강행태, 식생활 등 다양한 요인에 의해 영향을 받으므로 대사증후군 예방을 위해서는 생활습관 개선이 강조되었다[12,13]. 식이개선은 대사증후군 관리에 가장 중요한 요소로써, 항염증 식이는 중년 여성의 혈당 개선에 효과가 있었으며[14], 다양하고 절제된 식품의 섭취는 대사 위험인자 감소 효과를 보였다[15]. 또한 지중해식 식단은 심혈관질환, 당뇨병 등의 위험이 감소되었고[16], 과일, 채소, 저지방 유제품, 콩류, 생선, 가금류 및 견과류의 섭취 순응도가 높을수록 대사증후군 유병률이 감소되어[17], 대사증후군 관리에 식생활의 중요성이 확인되었다.
이상의 연구를 통하여 대사증후군은 대사 위험인자가 군집을 이루어 나타나는 질환으로서 대사 위험인자의 구성 패턴에 따른 관리의 차별화가 필요할 것으로 여겨진다. 통계청의 2021년에 한국 성인의 대사 위험인자 보유 현황[2]에 대한 발표를 보면, 복부비만 25.7%, 높은 혈당 41.6%, 높은 혈압 44.6%, 낮은 HDL (high density lipoprotein)-콜레스테롤혈증 15.1%, 고중성지방혈증 17.9%로, 이들 대사 위험인자의 구성 패턴에 따라 복합적 대사이상은 심뇌혈관질환 또는 지방간과 연계될 것으로 여겨진다. 따라서 본 연구는 한국 성인을 대상으로 대사 위험인자 패턴에 따른 영양소 섭취 수준을 알아보고, 대사 위험인자 패턴과 심뇌혈관질환 또는 지방간의 발생 위험률과의 관련성을 파악하여 대사 위험인자 패턴에 따른 맞춤형 영양관리 전략 수립을 위한 근거를 제공하고자 하였다.
연구 방법
연구대상
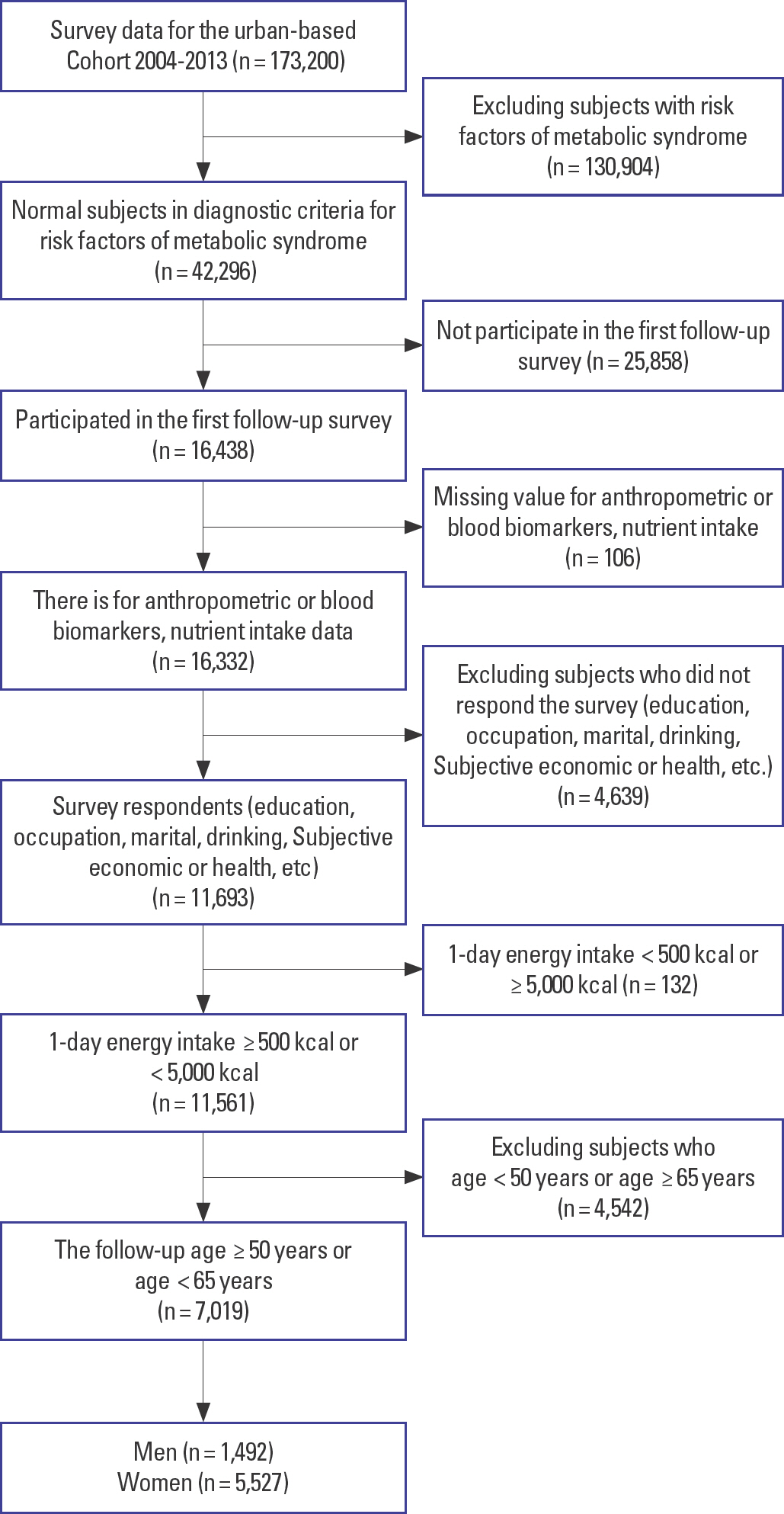
본 연구는 질병관리본부 한국인유전체역학조사사업(Korean Genome and Epidemiology Study, KoGES) 중 하나인 도시기반 코호트의 기반조사(2004-2013년)부터 1차 추적조사(2012-2016년)까지의 자료를 사용하였다. 도시기반 코호트는 전국 대도시, 중소도시 지역의 의료기관, 보건소와 보건의료원 등을 중심으로 건강검진 센터에 내원한 40-69세 남성과 여성을 대상으로 생활습관, 식이요인, 만성 질환의 환경적 요인 등에 대한 조사가 지침서 단계에 따라 실무 조사원에 의해 수행되었다. 대상자는 Figure 1에 나타낸 바와 같이 기반조사(n=173,200)와 추적조사(n=65,610)에 참여한 대상자 중 기반조사에서 대사증후군 위험인자인 허리둘레. 혈압, 혈당, 중성지질, HDL-콜레스테롤의 수치가 정상인 대상자(n=42,296)를 추출하였고, 추적조사에 미참여 대상자(n=25,858)를 제외한 16,438명을 추출하였다. 이들 중에서 신체계측, 혈액검사 및 영양조사 자료가 없는 대상자(n=106)를 제외한 참여자(n=16,322) 중 설문조사 무응답자(n=4,745)를 제외한 11,693명을 추출한 후, 식품의 극단적인 섭취자를 제외하기 위하여 하루 총 에너지 섭취량이 500 kcal 미만이거나 5,000 kcal 이상인 대상자(n=132)를 제외하고, 50세 미만이거나 65세 이상인 대상자(n=4,542)를 제외한 만 50-64세 성인 7,019명(남: n=1,492, 여: n=5,527)을 대상으로 분석하였다. 대상자의 연령 선정은 본 연구자들의 선행 연구[3]와 통계청 발표 대사증후군의 유병률을 감안하여 만 50-64세로 하였다[2]. 대상자 분류는 기반조사에서 대사 위험인자를 보유하지 않은 대상자를 추출하여 추적조사에서 대사 위험인자 패턴에 따라 대사 위험인자를 보유하지 않은 대상자는 정상(normal, NOR)군, 복부비만이나 높은 혈당 보유한 대상자는 비만 위험인자(Obesity risk factors, ORF) 패턴, 높은 혈압이나 높은 중성지방, 낮은 HDL-콜레스테롤 보유한 대상자는 혈관 위험인자(Vascular risk factors, VRF) 패턴, 비만 위험인자와 혈관 위험인자를 동반하여 보유한 대상자는 클러스터 위험인자(Cluster risk factors, CRF) 패턴으로 분류하였다. 본 연구는 경북대학교 생명윤리위원회(Institutional Review Board, IRB)의 심의에서 면제승인을 받았다(IRB No.: KNU-2021-0253).
연구내용 및 방법
인구사회학적 특성 및 건강행태
조사대상자의 인구사회학적 특성은 기초조사와 추적조사에 있는 공통 변수 중 연령, 교육수준, 주관적 경제상태 및 주관적 건강상태 변수를 사용하였고, 건강행태는 는 음주, 흡연 및 규칙적 운동 여부 등의 변수를 이용하였다. 교육수준은 ‘초졸 이하’, ‘중졸’, ‘고졸’, ‘대졸 이상’으로 분류하였다. 대상자 스스로가 인지하고 있는 주관적 경제상태에서 여유가 있다는 응답자는 ‘좋음’으로, 지낼 만하다는 ‘보통’으로, 조금 어렵거나 매우 어렵다 응답자는 ‘나쁨’으로 재분류하였다. 주관적 건강상태는 매우 건강하다와 건강하다 응답자는 ‘좋음’으로, 보통이다 응답자는 ‘보통’, 건강하지 못하거나 매우 건강하지 못하다 응답자는 ‘나쁨’으로 재분류하여 분석하였다. 음주 상태는 ‘비음주’, ‘과거음주’, ‘현재음주’로 하였고, 흡연 상태는 ‘비흡연’, ‘과거흡연’, ‘현재흡연’으로 분류하였다. 규칙적 운동 여부는 몸에 땀이 날 정도의 운동을 규칙적으로 하는가에 따라 ‘예’, ‘아니오’로 구분하였다.
신체계측 및 혈액검사
대상자의 신장은 신장계 수평판이 머리의 정점에 닿게 한 후 측정하였으며, 체중은 두 발에 체중이 골고루 분포되도록 한 후 체중계 눈금이 안정될 때 10 g 단위까지 측정하였다. 체질량지수(body mass index, BMI)는 신장과 체중으로 산출하여, 저체중(BMI<18.5 kg/m2), 정상체중(BMI 18.5-22.9 kg/m2), 과체중(BMI 23.0-24.9 kg/m2), 비만(BMI≥ 25 kg/m2)으로 분류하였다[18]. 허리둘레는 늑골과 장골능선 사이 중간 부인 둘레를 수평을 유지한 상태로 측정하였고, 수축기 혈압과 이완기 혈압 측정은 5분 정도 안정을 취하게 한 뒤 수은 혈압계를 이용하여 최소 1분 이상 간격으로 3회 반복 측정하여 평균값을 구한 자료를 사용하였다. 공복혈당, 혈중 중성지방, HDL-콜레스테롤 등의 혈액검사는 일원화된 중앙검사실에서 진행되었고, 공복상태에서 채취하였다.
대사 위험인자 분류 기준
대사 위험인자 분류 기준은 NCEP-ATPIII (National Cholesterol Education Program-Adult Treatment Panel III)의 기준을 적용하였다[19]. 복부 비만은 허리둘레가 남성 90 cm 이상, 여성 85 cm 이상으로 하였고[18], 높은 혈압은 수축기 혈압 130 mmHg 이상이거나 이완기 혈압 85 mmHg 이상, 높은 혈당 기준은 공복혈당 100 mg/dL 이상, 높은 중성지방은 150 mg/dL 이상, 낮은 HDL-콜레스테롤 기준은 남성은 40 mg/dL 미만, 여성은 50 mg/dL 미만으로 하였다. 그리고, 기반 이후 의사 진단 여부의 질문에 ‘예’로 응답한 대상자는 고혈압, 당뇨병, 이상지질혈증 구성요소를 보유하고 있는 것으로 판정하였다.
영양소 섭취량 및 영양소 질적 수준
영양소 섭취량 및 영양소 질적 수준 평가는 106개 문항으로 구성된 KoGES의 반정량 식품빈도설문지(Semi-quantitative food frequency questionnaire, SQFFQ)조사로 추정된 영양소 섭취량을 이용하여 분석하였다. SQFFQ의 타당도와 신뢰도 검증은 3일간 식사기록을 이용하여 이루어졌으며, 지난 1년간 섭취한 식품/음식의 평균적인 섭취빈도는 ‘거의 안 먹음’, ‘한 달에 1회’, ‘한 달에 2-3회’, ‘일주일에 1-2회’, ‘일주일에 3-4회’, ‘일주일에 5-6회’, ‘하루 1회’, ‘하루 2회’, ‘하루 3회’로 분류되었다. 평균 1회 섭취분량은 ‘소’(표준 크기의 절반), ‘중’(표준 크기), ‘대’(표준크기 1.5배) 로 구성되었다. 영양소 질적 수준 평가에서 영양소 적정섭취 비율(nutrient adequacy ration, NAR)은 2020 한국인 영양소 섭취기준(2020-Dietary reference intakes for koreans, KDRIs) [20]에 제시된 권장섭취량(recommended nutrient intake, RNI)을 이용하여 각 영양소의 권장섭취량 대비 실제 섭취량의 비율로 산출하였으며, 산출한 값이 1.0 이상인 경우는 1.0으로, 1.0 미만이면 기존 값으로 산정하였다[21]. 평균 영양소 적정섭취 비율(mean adequacy ratio, MAR)은 단백질, 칼슘, 인, 철, 아연, 비타민 A, 엽산, 니아신, 티아민, 리보플라빈, 비타민 B6, 비타민 C의 12종 영양소의 NAR 평균값으로 산출하였으며[21], 영양소 밀도지수(index of nutritional quality, INQ)는 에너지 필요추정량 1.000 kcal 당 영양소 권장섭취량 대비 대상자가 섭취한 에너지 1,000 kcal당 영양소 섭취량 비율로 산출하였다[22].
심뇌혈관질환과 지방간 정의
대사 위험인자의 복합적 대사이상으로 다른 질환과 연계되어 발생되는 질환으로서 심뇌혈관질환과 지방간의 발생률을 분석하였다. 질병 발생의 정의는 설문 조사에서, ‘기반조사 이후에 의사로부터 뇌졸중(중풍) 진단을 받은 적이 있습니까? 기반조사 이후에 의사로부터 협심증 또는 심근경색 진단을 받은 적이 있습니까?’ 의 두 질문 중 하나 이상 ‘예’로 답한 응답자는 심뇌혈관질환이 있는 것으로 판단하였고, ‘기반조사 이후에 의사로부터 지방간 진단을 받은 적이 있습니까?’에서 ‘예’로 답한 응답자는 지방간 질환이 있는 것으로 정의하였다. 본 연구에서는 심뇌혈관질환 또는 지방간 두 가지 질환을 합하여 발생위험 분석에 사용하였다.
통계분석
자료는 SPSS 26.0 (IBM Corporation, Armonk, NY, USA) 프로그램을 사용하였으며, 남성과 여성을 구분하여 대사 위험인자 패턴에 따른 인구사회학적 특성 등의 비연속 변수는 교차분석 후 빈도와 백분율로 나타내었다. 신체계측, 혈액검사, 일일 영양소 섭취량, 영양소 질적 수준 등의 연속변수는 분산분석 후 평균과 표준편차로 나타내었으며, 사후검정은 Duncan’ multiple range test로 하였다. 대사 위험인자 패턴 및 평균 영양소 적정섭취 비율에 따른 심뇌혈관질환 또는 지방간의 발생 위험률 (hazard ratio, HR)과 95% 신뢰구간(confidence interval, CI)은 Cox 회귀분석으로 산출하였다. Model 1은 변수를 보정 하지 않았고, Model 2는 연령과 하루 총 에너지 섭취량 변수를 보정하였다. Model 3은 Model 2 보정변수에 교육수준, 주관적 경제상태 및 건강상태, 음주, 규칙적 운동여부를 보정한 후 분석하였다. 모든 분석에 대한 통계적 유의수준은 p <0.05로 판단하였다.
연구 결과
인구사회학적 특성 및 건강행태
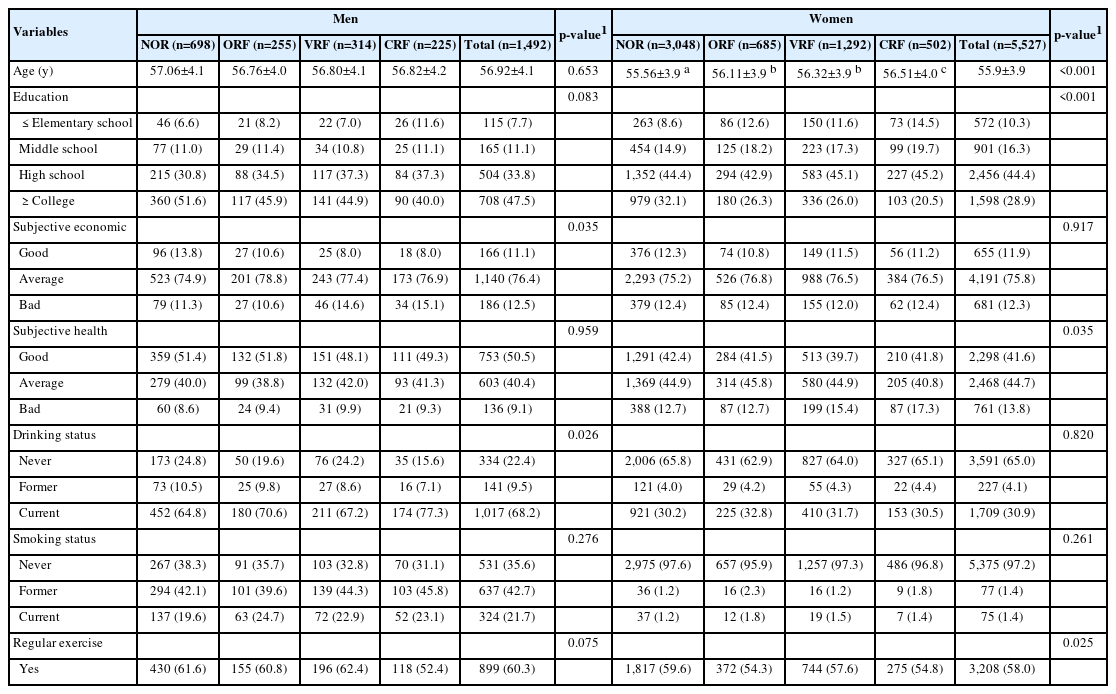
대상자의 대사 위험인자 패턴을 인구사회학적 특성 및 건강행태별로 비교한 결과는 Table 1과 같다. 남성은 주관적 경제상태와 음주상태에서 대사 위험인자 패턴간 유의한 차이가 나타났으며, 주관적 경제상태가 ‘나쁘다’로 인식하는 대상자는 CRF 패턴에서 15.1%로 높았고(p <0.05), 현재 음주 중인 대상자의 분율은 CRF 패턴(77.3%)과 ORF 패턴(70.6%)에서 높았다(p <0.05). 여성의 경우 연령, 교육수준, 주관적 건강상태 및 규칙적 운동여부에서 대사 위험인자 패턴 간 차이가 있었다. 평균 연령은 CRF 패턴에서 56.51±4.0세로 높았고(p <0.001), 초졸 이하 대상자도 CRF 패턴에서 14.5%로 높았으며(p <0.001), 주관적 건강상태에 대해 ‘나쁘다’로 인식하는 대상자의 분율 역시 CRF 패턴에서 17.3%로 높게 나타났다(p <0.05). 반면에 규칙적으로 운동을 실천하는 대상자 분율은 ORF 패턴(54.3%)과 CRF 패턴(54.8%)에서 낮았다(p <0.05).
대상자의 신체계측 및 혈액성상
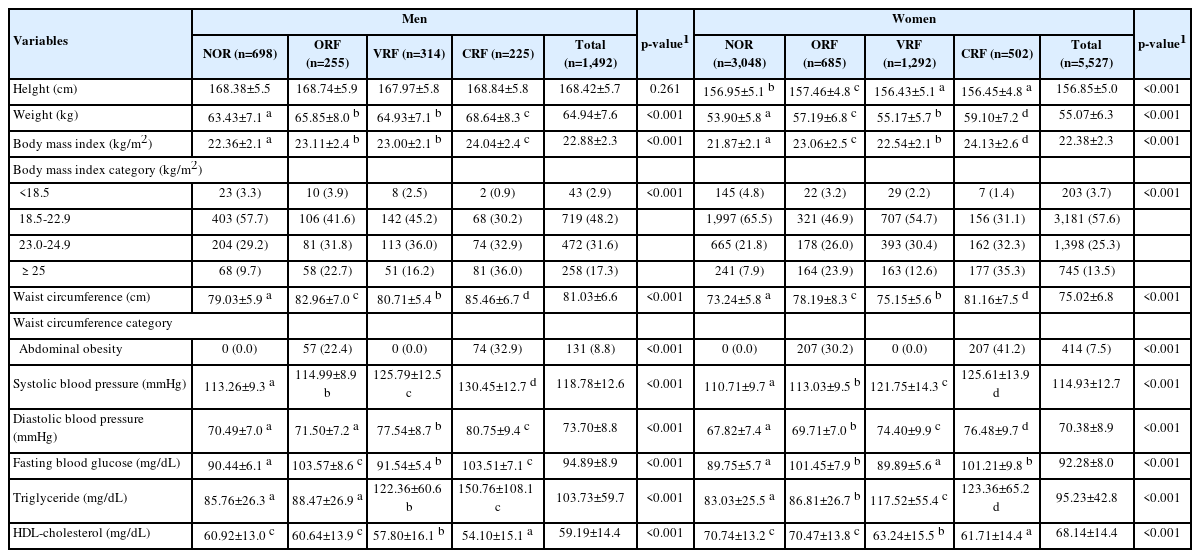
대상자의 신체계측 및 혈액성상 결과는 Table 2와 같다. 남성의 경우, BMI와 허리둘레는 CRF 패턴에서 24.04±2.4 kg/m2와 85.46±6.7 cm로 가장 높았고(p <0.001), CRF 패턴에서는 비만 36.0%, 복부비만 32.9%로 비만과 복부비만 대상자 역시 유의하게 높았다(p <0.001). CRF 패턴의 수축기 혈압과 이완기 혈압은 130.45±12.7 mmHg와 80.75±9.4 mmHg 로 가장 높았고(p <0.001), 다음 순으로 VRF 패턴에서 수축기혈압과 이완기혈압이 높았다. 혈액성상에서 공복혈당은 ORF 패턴과 CRF 패턴에서 103.57±8.6 mg/dL와 103.51±7.1 mg/dL로 높았고(p <0.001), 중성지질은 CRF 패턴과 VRF 패턴에서 150.76±108.1 mg/dL와 122.36±60.6 mg/dL로 NOR군과 ORF 패턴에 비해 유의하게 높았다(p <0.001). HDL-콜레스테롤 농도는 CRF 패턴에서 54.10±15.1 mg/dL로 가장 낮았고, 다음으로 VRF 패턴(57.80±16.1 mg/dL)이었다(p <0.001). 여성의 경우, BMI와 허리둘레는 CRF 패턴에서 24.13±2.6 kg/m2와 81.16± 7.5 cm로 가장 높게 나타났고(p <0.001), 다음 순으로 ORF 패턴(BMI 23.06±2.5 kg/m2, 허리둘레 78.19±8.3 cm)에서 높았다(p <0.001). 비만과 복부비만 대상자 분율 역시 CRF 패턴(비만 35.3%, 복부비만 41.2%)과 ORF 패턴(비만 23.9%, 복부비만 30.2%)에서 NOR군과 VRF 패턴보다 유의하게 높았다(p <0.001). 수축기 혈압과 이완기 혈압은 CRF 패턴에서 125.61±13.9 mmHg와 76.48±9.7 mmHg로 가장 높았고, 다음으로 VRF 패턴(수축기 혈압 121.75±14.3 mmHg, 이완기 혈압 74.40± 9.9 mmHg)이 높았다(p <0.001). 혈액성상에서 공복혈당은 ORF 패턴(101.45±7.9 mg/dL)과 CRF 패턴(101.21±9.8 mg/dL)에서 가장 높았고(p <0.001), 중성지질은 CRF 패턴에서 123.36±65.2 mg/dL로 가장 높았으며, 다음으로 VRF 패턴 (117.52±55.4 mg/dL)이 높았다(p <0.001). HDL-콜레스테롤 농도는 CRF 패턴에서 61.71±14.4 mg/dL로 가장 낮았고, 다음으로 낮은 군은 VRF 패턴(63.24±15.5 mg/dL)이었다(p <0.001).
대사 위험인자 패턴과 영양소 섭취상태
대상자의 영양소 섭취량에 대한 결과는 Table 3과 같다. 남성의 경우 대사 위험인자 패턴에 따른 영양소 섭취량에 유의한 차이가 없었다. 여성의 경우는 군간 차이를 보인 영양소 중에서 단백질을 비롯한 13종 영양소의 섭취량이 NOR군에 비해 VRF 패턴에서 유의하게 낮았다. 이들 영양소 중 전체 대상자의 칼슘, 비타민 A 및 엽산의 섭취량은 KDRIs [20]의 RNI에 비해 섭취량이 낮은 수준이었지만, 특히 VRF 패턴의 비타민 A의 섭취량(422.48±245.0 μg RAE)은 KDRIs [20] RNI 600 μg RAE의 약 70%이었고, 칼슘(409.73±211.3 mg)과 엽산 섭취량(190.03±92.2 μg DFE)은 KDRIs [20] RNI (칼슘 800 mg, 엽산 400 μg DFE)의 약 50% 수준이었다. 여성의 탄수화물 에너지 분포 분율에서 전체 대상자가 KDRIs [20]의 에너지 적정 비율(acceptable macronutrient distribution ranges, AMDR) 기준 55-65% 보다 높은 분포였으며, 특히 VRF 패턴의 탄수화물 AMDR은 70.80±7.2%로 다른 군에 비해 유의하게 높았다(p <0.001).
대사 위험인자 패턴과 영양소 적정섭취 비율 및 평균 영양소 적정섭취 비율
대사 위험인자 패턴에 따른 NAR과 MAR은 Table 4와 같으며, 남성 대상자에서는 대사 위험인자 패턴에 따른 NAR과 MAR의 영양소 질적 수준은 유의한 차이가 없었지만, 여성 대상자에서는 군간 유의한 차이가 나타났다. 여성 VRF 패턴은 NOR군에 비해 단백질(p <0.05), 칼슘(p <0.01), 아연(p <0.01), 비타민 A(p <0.05), 엽산(p <0.01), 니아신(p <0.05), 리보플라빈(p <0.05)의 NAR이 유의하게 낮았고, 특히 NAR 이 0.75 미만으로 나타난 영양소는 칼슘(0.50±0.2), 비타민 A(0.64±0.3), 엽산(0.47±0.2), 티아민(0.74±0.2) 및 리보플라빈(0.64±0.2) 5종이었다. 12종 영양소 NAR의 평균값인 MAR 역시 VRF (0.75±0.2) 패턴은 NOR (0.76±0.2) 군에 비해 유의하게 낮았다(p <0.05).
대사 위험인자 패턴에 따른 영양밀도 지수
Table 5에 나타낸 대사 위험인자 패턴에 따른 영양소 질적 수준 중 INQ 값에서 남성 대상자에서는 유의한 차이가 없었다. 여성 대상자의 경우, NOR 군에 비해 VRF 패턴과 CRF 패턴 모두에서 INQ 값이 유의하게 낮았던 영양소는 인과 철이었다(p <0.01), NOR 군보다 VRF 패턴에서 낮았던 영양소는 단백질(p <0.01), 아연(p <0.05) 및 리보플라빈(p <0.01)이었으며, CRF 패턴에서 낮게 나타난 영양소는 칼슘(p <0.01)과 비타민 C (p <0.05)이었다. INQ 평균이 1.0 미만 영양소의 종류로는 NOR 군, ORF 패턴 및 CRF 패턴은 칼슘, 비타민 A, 엽산, 티아민, 리보플라빈 5종이었고, VRF 패턴은 아연을 포함하여 6종이었다.
영양소 질적 수준과 심뇌혈관질환 또는 지방간 발생 위험도
대상자의 MAR 값을 4분위수로 분류하여 심뇌혈관질환 또는 지방간 발생 위험을 살펴본 결과는 Table 6과 같다. 남성의 경우 1,492명 중 37명(2.5%), 여성의 경우 5,527명 중 83명(1.5%)이 심뇌혈관질환 또는 지방간이 발생했다. 남·여 대상자의 영양소 질적 수준에 따른 이들 질환 발생 비율은 남성 MAR Q1 3.5%, Q2 1.6%, Q3 2.7%, Q4 2.2%이었고, 여성의 경우는 MAR Q1 1.9%, Q2 2.1%, Q3 0.6%, Q4 1.4% 발생하였다. 영양소 질적 수준과 심뇌혈관질환 또는 지방간 발생 위험률의 연관성을 알아보고자 MAR Q1을 참조집단으로 하여 분석한 결과 남성 대상자는 영양소 질적 수준과 심뇌혈관질환 또는 지방간 발생과의 관련성이 없었으나, 여성 MAR Q4 대상자는 Model 1에서 심뇌혈관질환 또는 지방간의 발생 위험률이 0.41배(HR, 0.41; 95% CI, 0.18-0.94) 낮았지만, 연령, 에너지를 보정한 Model 2와 연령, 에너지, 교육수준, 주관적 경제상태 및 건강상태, 음주, 규칙적 운동여부를 보정한 Model 3에서는 유의한 차이가 나타나지 않았다.
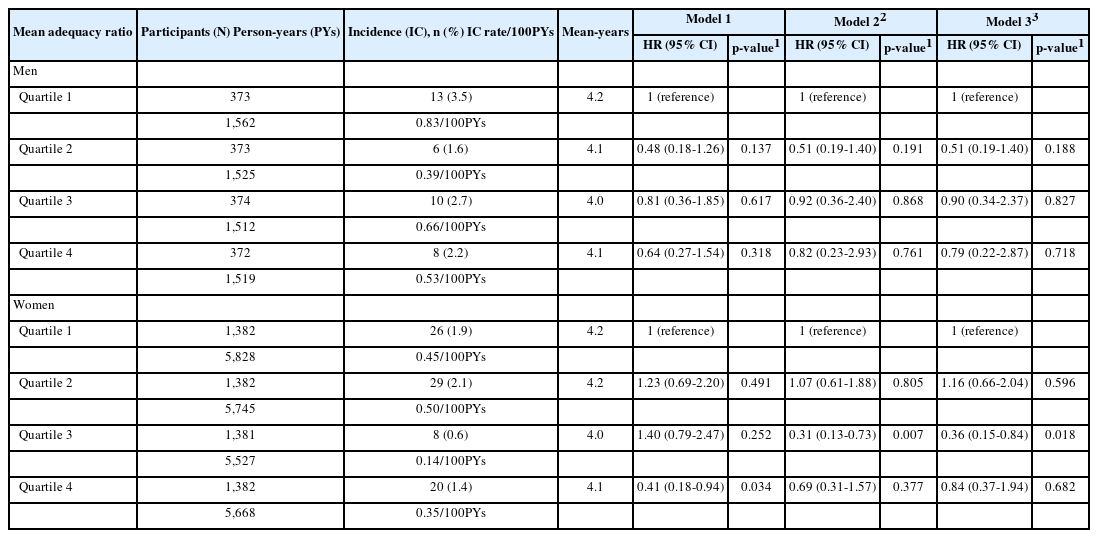
Hazard rations of incidence cardiocerebrovascular disease, fatty liver according to quartiles of mean adequacy ratio
MAR Q3 대상자는 참조집단에 비해 Model 2에서 0.31배(HR, 0.31; 95% CI, 0.13-0.73) 낮았고, Model 3에서 심뇌혈관질환 또는 지방간의 발생 위험률이 0.36배(HR, 0.36; 95% CI, 0.15-0.84) 낮았다.
대사 위험인자 패턴과 심뇌혈관질환 또는 지방간 발생 위험도
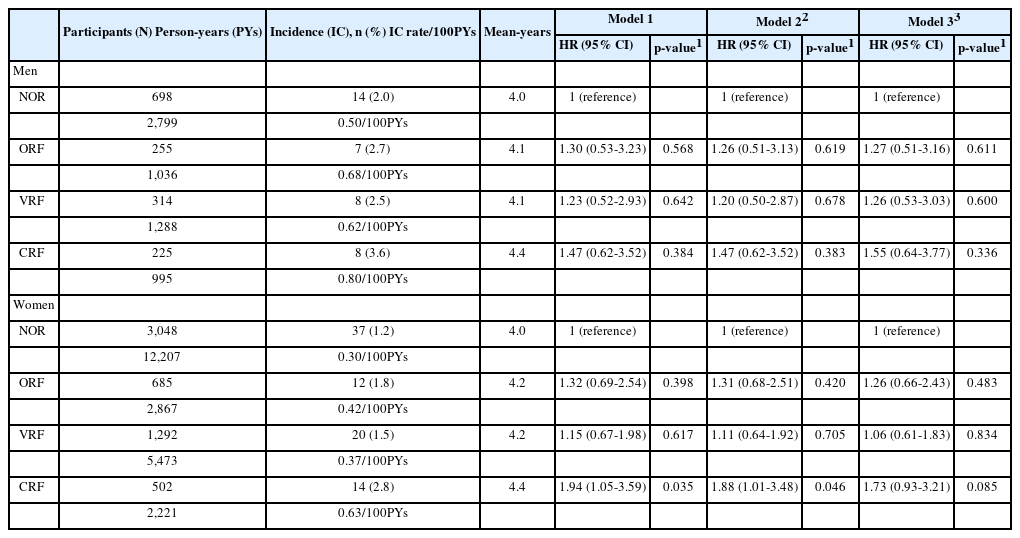
대상자의 대사 위험인자 패턴에 따른 심뇌혈관질환 또는 지방간 발생 위험률은 Table 7과 같다. 전체 평균 추적관찰 기간은 4.1년이었으며, 대사 위험인자 패턴에 따른 이들 질병 발생 비율은 남성의 경우 NOR 군 2.0%, ORF 패턴 2.7%, VRF 패턴 2.5%, CRF 패턴 3.6%이었고, 여성의 경우는 NOR 군 1.2%, ORF 패턴 1.8%, VRF 패턴 1.5%, CRF 패턴 2.8% 발생하였다. 심뇌혈관질환 또는 지방간 발생 위험률 분석에 교란인자를 보정한 세 모형을 사용한 결과에서 남성은 대사 위험인자 패턴에 따른 심뇌혈관질환 또는 지방간 발생 위험률에 유의한 차이가 없었다. 여성 CRF 패턴은 NOR 군에 비해 Model 1에서 1.94배(HR, 1.94; 95% CI, 1.05-3.59), Model 2에서 1.88배(HR, 1.88; 95% CI, 1.01-3.48)로 심뇌혈관질환 또는 지방간 발생 위험률이 높았으나, Model 3에서는 유의한 차이가 없었다.
고 찰
본 연구는 도시기반 코호트 자료를 이용하여 50-64세 한국 성인의 대사 위험인자 패턴에 따른 영양상태, 심뇌혈관질환 또는 지방간 발생 위험률과의 관련성을 알아보고자 하였다.
대사 위험인자 패턴과 대상자의 인구사회학적 특성 및 건강행태와의 관련성에서 음주율이 높은 남성과 운동 실천율이 낮은 여성은 대사 위험인자 패턴 중 ‘ ORF’ 패턴과의 관련성이 높았다. 높은 음주율과 ‘ ORF’ 패턴과의 관련성은 남성 1,055명과 여성 1,268명을 대상으로 알코올 섭취량과 허리-엉덩이 둘레비(waist-to-hip ratio, WHR)와의 관련성 연구에서 음주량과 WHR 사이에는 J-형 관련성이 나타난 결과[23]와 유사하였고, 대사증후군과 음주 관련성 연구에서 비음주자에 비해 하루 알코올 30-79.9 g 마시는 남성은 복부비만 위험이 1.08배, 알코올 80 g 이상을 음주하는 남성은 복부비만 위험이 2.02배로 상승한 결과[24]와 맥을 같이 하였다. 낮은 운동 실천과 ‘ ORF’ 패턴과의 관련성에서는 신체활동 일수가 1일 이하인 대상자보다 2일 이상인 대상자의 공복혈당이 낮았고[25], 운동 실천이 낮은 완경 여성은 복부비만과 공복혈당 등의 대사증후군 보유 개수가 증가한 결과[3] 등을 통해 남성의 높은 음주와 여성의 낮은 운동 실천율은 ‘ ORF’ 패턴의 영향 요인으로 여겨진다. 반면에 주관적 경제수준이 나쁘다고 인식하는 남성과 주관적 건강상태가 나쁘다고 인식하는 여성은 대사 위험인자 패턴 중 ‘ VRF’ 패턴과의 관련성이 높았다. 경제수준에 대한 인식은 여성보다 남성에게 크게 작용하는 요인으로써 남성의 경제력 저하는 스트레스, 무력감, 우울감 등의 부정적 심리 요인으로 이어져 경제적 스트레스가 고혈당, 급성 심근경색 등의 혈관질환과 관련성이 있다는 보고[26,27]와 같이 남성의 경제수준에 대한 부정적 심리 요인은 ‘ VRF’ 패턴 형성에 영향을 미쳤을 것으로 여겨진다. 또한 주관적 건강상태가 나쁜 여성은 ‘ VRF’ 패턴과 관련성이 있는 것으로 나타났으며, 이는 운동 및 올바른 식생활 실천에 대한 의욕 저하는 삶의 질 저하와 관련성이 있는 것으로 추정되며[28], 당뇨환자를 대상으로 한 연구에서는 주관적 건강상태가 나쁜 당뇨환자는 당뇨 자가관리에 나쁜 영향을 미친 것으로 나타났다[29].
대사 위험인자 패턴에 따른 영양소 섭취량으로 살펴본 영양소 양적 수준 평가에서 먼저, 남·여 대상자의 탄수화물의 섭취량(270-310 g)과 탄수화물 에너지비율(약 70%)은 KDRIs [20]의 탄수화물 RNI 기준(130 g)과 탄수화물 AMDR 기준(55-65%)보다 높았다. 이처럼 대상자들의 탄수화물 섭취량 및 에너지비율 증가는 인슐린 감수성을 약화시켜 내당능장애 및 이상지질혈증 등의 대사질환에 부정적인 영향을 미칠 수 있으므로[30], 혈당 항상성을 위해 탄수화물 에너지 비율이 적정한 범위내로 관리되어야 할 것으로 여겨진다. 탄수화물을 제외한 대부분 영양소의 섭취량이 KDRIs [20]의 RNI 기준량에 미치지 못하였고, 그 중 칼슘과 엽산 섭취량은 KDRIs [20]의 RNI 기준량의 약 50% 정도로 낮았다. 영양소의 질적 평가에서 여성 VRF 패턴은 단백질, 칼슘, 아연, 비타민 A, 엽산, 니아신, 리보플라빈의 7종 영양소 NAR과 단백질, 인, 철, 아연, 리보플라빈의 5종 영양소 INQ가 NOR 군에 비해 낮게 나타났다. 이러한 영양소의 양적, 질적 수준 평가에서 나타난 결과를 토대로 살펴보면, 여성 VRF 패턴에 영향을 미친 단백질은 근육량 유지와 혈당 조절, 혈관의 탄력 유지와 혈액의 지단백 조성 등에 결정요인 영양소[31]로, 류신, 라이신, 알라닌 등의 일부 아미노산은 인슐린 분비를 자극하여 염증성 혈관질환 발병 위험을 낮춘다[32]. 또한 남성과 여성 78,851명 대상의 네덜란드, 핀란드, 캐나다 코호트 연구에서 체중 kg당 단백질 섭취량이 많을수록 당뇨병 전단계와 당뇨병의 발병 위험이 감소됨으로써 당뇨병을 비롯한 대사 질환 관리에 총 단백질 섭취량 증가의 필요성을 강조하였다[33]. 그러나, 대사 위험인자 개선과 관련하여 이상적인 단백질 섭취량은 에너지 섭취량의 7-20%정도를 권장하고 있는 KDRIs [20]의 AMDR 기준을 참고하여 50세 이상 남·여 성인의 단백질 에너지 비율 15-20%는 우리나라 50세 이상 성인의 75-95 백분위수에 해당함으로[34]이므로 ‘ VRF’ 패턴 예방을 위해 단백질의 에너지 비율이 15-20% 정도로 충분한 섭취가 이루어져야 할 것으로 여겨진다. 또한 ‘ VRF’ 패턴에 영향을 미친 칼슘은 신장에서 나트륨 배설 증가시킴으로써, 대시(dietary approaches to stop hypertension, DASH) 식단에 마그네슘, 칼륨 등과 함께 칼슘의 급원 식품이 첨가되어 있으며, 임상적으로 유의미한 혈압 강하 효과[35]가 있는 영양소로 알려져 있다. 이에 칼슘 급원식품의 맛과 영양을 높이는 방안을 모색하여 칼슘이 양적·질적으로 부족한 ‘ VRF’ 패턴을 보유한 여성뿐 아니라 50세 이상 성인의 칼슘 섭취량을 높여야 할 것이다. 비타민 A는 혈관내피세포를 개선하여 혈관 순환을 원활하게 하고, 항염증성 기능으로 포도당의 자가 산화 대사에 효과적인 영양소이다[14,36]. 그리고, 엽산은 고호모시스테인혈증 및 심혈관질환 발병 위험을 낮추는 영양소로 보고되어[37,38], 이들 비타민 A와 엽산의 섭취 부족은 ‘ VRF’ 패턴 및 대사증후군 합병증의 발생 위험과 밀접한 연관이 있음이 입증되었다[36,37]. 이처럼 질병과 단일 영양소와의 관련성 결과에서 식생활의 중요성이 확인되었지만, 우리가 먹는 식품에는 단일 영양소 형태가 아닌 여러 종류의 영양소가 식품 속에 혼재되어 있으므로, 이들 전체 영양소의 섭취 수준을 평가하는 것 또한 의미가 클 것이다. 이에 12종 영양소의 MAR을 이용하여 대사 위험인자 패턴에 미치는 영향에서 여성 VRF 패턴에서 NOR 군에 비해 유의하게 낮아, 여성의 ‘ VRF’ 패턴 감소를 위해서는 단일 영양소의 섭취량 증가뿐 아니라 여러 영양소의 균형적인 섭취가 이루어져야 할 것으로 여겨지며, 한국 50-64세 완경 여성 1,369명 대상의 대사증후군 위험인자 연구에서 완경기 대사증후군 예방을 위해 다양한 영양소 섭취와 영양표시제 실천을 강조하였다[3]. 그러나 남성의 경우에서는 대사 위험인자 패턴에 따른 영양소의 양적·질적 수준 평가에 군간 차이가 나타나지 않았던 점은 두 가지 관점에서 생각해 볼 수 있다. 하나는 남성의 경우 사회교육 시스템의 영향으로 영양관리 능력에서 거의 비슷한 수준으로 군 간 차이가 나타나지 않았을 경우이다. 또 하나는 남성 대상자의 표본 크기가 충분하지 않아 통계적 검정력이 약화된 것으로 여겨지며[39], 차후 연구에서 연구결과 해석의 타당성과 일반성을 고려한 적정 수의 표본이 확보하여 분석하도록 과제로 남기겠다.
심뇌혈관질환 또는 지방간 발생 위험과 대상자의 MAR 수준을 살펴본 결과에서 MAR Q3 대상자는 Model 2에서 심뇌혈관질환 또는 지방간의 발생 위험률이 69.0% (HR, 0.31; 95% CI, 0.13-0.73) 감소하였고, Model 3에서 64.4% (HR, 0.36; 95% CI, 0.15-0.84) 감소하였다. 이로써 대사증후군 합병증 발생 위험이 영양소 질적 수준에 영향을 받았으며, 식사 질과 대사 위험인자의 관련성 및 질환의 발생률과의 관련성을 제시한 선행 연구를 보면, 한국 성인 18,652명 대상의 횡단연구에서 대사 위험인자 보유수 증가에 따라 식이 질 점수가 감소하였다[15]. 그리고, DASH 식단과 심혈관질한 발생률을 메타분석으로 연구한 결과에서는 DASH 식단 대상자는 심혈관질환과 뇌졸중의 발생 위험이 각각 20%와 19% 감소되어, 양호한 식사의 질은 대사증후군 위험인자와 심뇌혈관합병증 위험을 감소시킴을 확인하였다[40]. 하지만 본 연구의 여성 MAR Q4에서 심뇌혈관질환 또는 지방간 발생에 대한 유의한 효과가 나타나지 않았던 것은 MAR 산출에 이용된 NAR 계산에서 과잉섭취가 걸러지지 못하고, 최고점수인 1.0점에 포함되었기 때문으로 판단되며, 편견 없는 식사 질 평가는 추후 연구 과제로 남기겠다.
본 연구는 연구 모집단이 전체 모집단을 대표하는 무작위 표본이 아닌 점을 고려해서 결과를 해석해야 하는 제한점을 갖지만, 비교적 큰 규모의 도시 기반 코호트에서 대사 위험인자 패턴과 심뇌혈관질환 또는 지방간의 발생에 미치는 영향을 전향적으로 추적한 점에서 강점이 있다.
결 론
본 연구는 한국 성인을 대상으로 대사 위험인자 패턴과 영양소 섭취수준과의 관련성 및 대사 위험인자 패턴과 질병 발생 위험률과의 관련성을 알아보고자 설계되었다. 본 연구의 결과에서 대사 위험인자 패턴은 영양소 질적 수준에 영향을 받는 것으로 확인되었다. 이에 대사 위험인자 감소와 대사증후군과 연계된 질병 감소를 위해서는 특정한 단일 영양소의 개념보다 여러 가지 영양소가 포함한 다양성과 균형성 및 절제성이 통합된 맞춤형 영양관리가 필요하며, 본 연구의 결과는 영양관리 전략 수립의 근거로 활용될 수 있을 것으로 사료된다.