자발적 부작용보고자료를 이용한 의약품 상호작용 실마리 정보 탐색 방법
Statistical Methodologies for Detecting Drug-Drug Interaction Using Spontaneous Reporting System
Article information
Trans Abstract
Statistical methodologies of signal detection for drug-drug interactions (DDIs) have been developed and used. In this study, we review methodologies for DDI signal detection using the spontaneous reporting system. We describe the characteristics of the additive and multiplicative risk model, logistic regression model, Multi-item Gamma-Poisson Shrinker, Ω shrinkage measure model, and Chi-square statistics model. We discuss the advantages and disadvantages of each methodology along with examples, providing researchers with information to choose the most appropriate methodology for their study.
서 론
약물-약물 상호작용(drug-drug interaction)은 한 종류 이상의 약물을 동시에 복용함으로써 효과에 변화가 일어나는 현상을 의미한다[1]. 노령인구 및 동반질환을 가진 인구가 증가하고, 의학기술이 발전함에 따라 여러 약물을 동시에 복용하는 ‘다제약물 복용(polypharmacy)’이 흔한 현상이 되었으며 이로 인해 약물-약물 상호작용이 발생할 수 있다[2]. 약물 상호작용은 약물의 효능 및 부작용에 영향을 미칠 수 있으며, 경우에 따라 생명을 위협하거나 심각한 부작용으로 이어질 수 있다[3,4]. 상호작용으로 인한 약물 이상반응은 예상하지 못한 약물 이상 반응의 최대 30%를 차지하는 것으로 추정되며 이는 사회적, 경제적으로 상당한 손실을 야기하므로 예방대책이 필요하다[5,6]. 국내에서는 처방조제지원서비스를 실시하여 병용 금기, 연령 금기 의약품 등의 처방조제를 사전에 예방하고 있으며, 일부 대학병원에서는 임상정보를 기반으로 하는 실시간 부작용 모니터링 프로그램을 통해 임상의의 판단에 따라 처방 진행을 중단하는 환자안전제도를 운영하고 있다[5]. 그러나 약물-약물 상호작용은 약물의 흡수, 분포, 대사, 배설 및 약효 발현 단계에서 다양하게 나타날 수 있기 때문에, 단순히 잠재적인 병용 조합의 위험성을 알려주는 단계에서 나아가 실마리 정보와 지식베이스를 연결하여 실시간으로 점검하는 약물 부작용 감시시스템 등 더욱 정교한 기법에 대한 필요성이 대두되고 있다[5].
빈번한 신약 출시 및 시판 의약품에 대한 새로운 적응증 승인으로 인해 약물-약물 상호작용 발생을 인식하는 것은 더 어려워지고 있다[7]. 임상시험에서 모든 약물-약물 상호작용에 대한 효능과 안전성을 조사하는 것은 현실적으로 실현하기 어렵다[8]. 이러한 시험의 대부분은 단일 약물 효과에 초점을 맞추고 있으며, 동반 질환으로 인한 약물 치료는 일반적으로 엄격한 포함/제외 기준에 의해 제한되기 때문이다. 따라서 시판 후 모니터링을 통해 임상적으로 의미 있는 약물-약물 상호작용을 사전에 탐색하는 것이 더욱 중요하며 알려지지 않은 약물-약물 상호작용은 시판 후 약물감시 데이터베이스 분석을 통해 발견될 수 있다[9]. 약물-약물 상호작용에 의해 제기된 고차적 관계를 찾기 위해 자발적보고 시스템에서 약물과 특정 이상사례 조합의 연관성을 추론하는 다양한 방법이 개발되어 평가되고 있다[10].
자발적 부작용보고자료 데이터베이스는 시판 후 약물감시에서 중요한 역할을 하는 데이터베이스 중 하나로, 실마리 정보 파악을 위한 기초자료로 활용되고 있다. 실마리 정보란 약물과 이상사례 간의 새로운 잠재적 인과관계 또는 알려진 관계의 새로운 측면을 제시하는 정보로서, 하나 또는 그 이상의 보고원으로부터 얻어지는 정보 중에서 분석할 만한 가치가 있는 정보를 의미한다[11]. 자발적 부작용보고자료 및 실사용데이터(real-world data)를 이용한 연구는 시판 전에는 예측할 수 없던 약물-약물 상호작용을 탐색하는 중요한 보완책이 될 수 있으며, 의약품 상호작용으로 인한 부작용을 사전에 파악하고 보다 체계적인 의약품 사용 방향을 제시할 수 있다[12,13].
본 연구에서는 자발적 부작용보고자료의 특징을 정리하고 이를 이용하여 잠재적인 약물-약물 상호작용 실마리 정보 탐색 방법을 살펴보고자 한다. 방법론에 대한 설명과 더불어, 각각의 장점과 단점을 제시하여 연구자들은 보다 적절한 방법론을 선택하여 사용할 수 있을 것이다.
연구 방법
자발적 부작용보고자료
시판 후 약물 안전성을 평가하기 위한 방법으로 의약품 자발적 부작용보고자료를 활용하고 있다[14]. 미국 식품의약국(Food and Drug Administration, FDA)에서는 자발적 부작용보고시스템(FDA Adverse Event Reporting System, FAERS)을 구축하여 운영하고 있으며, 세계보건기구(World Health Organization, WHO)의 협력센터인 웁살라모니터링센터(Uppsala Monitoring Center, UMC)에서는 전 세계로부터 의약품 부작용 사례를 보고받으며 국제약물이상사례보고자료인 Vigi-Base를 관리하고 있다[15,16]. 우리나라에서는 소비자, 의약전문가, 제조∙수입업체, 지역의약품안전센터 등이 의약품 사용 후 이상사례를 의약품부작용보고시스템(Korea Adverse Event Reporting System, KAERS)을 통하여 보고한다. KAERS는 시판 후 의약품 등 투여 후 발생한 이상사례를 보고 및 관리할 수 있는 시스템이다. KAERS에 보고된 개별이상사례보고는 체계적으로 수집하여 스크리닝을 통해 입력오류 및 논리적 오류 등을 제외한 후 데이터클렌징을 통해 통일화된 형태로 코드를 부여하여 의약품부작용보고원시자료(KAERS database, KAERS DB)로 구축된다. 최근 한국의약품안전관리원(Korea Institute of Drug Safety, KIDS)에서 운영되었던 의약품부작용보고시스템(Korea Adverse Event Reporting System, KAERS)은 시스템 개편에 따라 2021년 6월 1일부터, KAERS-KIDS 시스템과 의약품통합정보시스템 의약품안전나라 시판 후 의약품 이상사례 시스템(KAERS-NeDrug)으로 병행 운영되었고 2023년 3월 8일부터 KAERS-NeDrug으로 일원화되어 운영되고 있다.
약물-약물 상호작용 기전
일반적으로 약물 상호작용은 한 약물의 효능 혹은 독성이 다른 약물, 음식, 음료, 환경화학 물질 등에 의해 변화될 때 일어나는 현상을 의미한다[17]. 약물 상호작용은 작용기전에 따라 약동학적 상호작용(pharmacokinetic interaction)과 약력학적 상호작용(pharmacodynamic interaction)으로 나눌 수 있다. 약동학적 상호작용이란 약물이 체내로 흡수되어 배설되기까지의 약물의 체내 동태변화에 영향을 미치는 것이다. 약력학적 상호작용은 약물의 수용체나 작용부위에 직접 또는 간접적으로 개입하여 임상효과 발현정도에 변화를 초래하는 것으로 병용 약물의 효과가 상가작용(additive), 상승작용(synergy), 길항작용(an-tagonism)을 보이거나 약물에 대한 조직의 민감성/반응성을 변화시키는 것이다. 상가작용은 약물의 효과가 두 약물을 각각 투여한 경우의 합일 때를 의미하며 상승작용은 각각 투여한 경우보다 효과 큰 경우, 길항작용은 각각의 효과를 감소시키는 것을 의미한다.
연구 결과
가법위험모형과 승법위험모형
가법위험모형(additive risk model)은 약물과 관련된 위험이 가산적(덧셈)으로 증가한다고 가정하며 승법위험모형(multiplicative risk model)은 약물과 관련된 위험이 상승적(곱셈)으로 증가한다고 가정한다[18]. 가법위험모형에서는 각 약물이 서로 영향을 주지 않아 각 약물 위험의 합이 측정값이 된다. 따라서 약물 상호작용의 실마리 정보로 나타나지 않은 경우, 약물 A 단독 복용과 관련된 위험은 약물 A와 약물 B를 함께 복용하였을 때 위험과 동일하다. 잠재적인 실마리 정보로 나타날 경우, 각각의 약물 복용으로 기대되는 위험보다 두 약물을 동시에 복용하였을 때 위험의 합이 더 크게 나타난다.
이는 RDAB = risk(A,B) - risk(not A, not B) 이므로, RDAB = RDA + RDB 임을 의미한다(RD: risk difference). 따라서, RDAB > RDA + RDB > 0 일 때, 각 개별 약물에 대해 예측되는 값과 비교하여 상호작 용에 의해 위험이 증가할 수 있음을 나타낸다. 승법위험모형에서는 약물 상호작용의 실마리 정보로 나타나지 않는 경우, 약물 A와 약물 B 의 동시 복용과 관련된 이상사례의 비율이 약물 A와 약물 B를 각각 복용하였을 때 이상사례의 위험 비율과 동일하다. 잠재적인 실마리 정보로 나타날 경우, 약물 A만 복용하였을 때 이상사례의 위험 비율과 B 약물 만 복용하였을 때 이상사례의 위험 비율이 약물 A와 약물 B를 동시 복용하였을 때 이상사례 위험 비율과 다르게 나타난다.
즉, RRA = risk(A, not B)/risk(not A, not B) 일 때, RRAB = RRA × RRB 이다(RR: relative risk). 따라서
Thakrar et al. [18]의 연구에서는 가법 및 승법위험모형을 적용하여 FDA의 자발적약물부작용 자료에서 각각 네 가지의 알려진 약물 상호작용과 알려지지 않은 약물 조합-이상사례 실마리 정보를 탐색하였다. 가법위험모형을 이용한 측정값이 0보다 크게 관찰되어(p-value<0.05) 알려진 네 가지 상호작용을 실마리로 탐색하였으며, 승법모형에서는 측정값이 1보다 크게 관찰되어(p-value<0.05) 알려진 두 가지 조합이 상호작용 실마리 정보로 탐색되었다. Antonazzo et al. [19]의 연구에서는 FAERS를 사용하여 경구용 포도당 저하제인 Dipeptidyl peptidase-4 (DPP-4) 억제제와 스타틴 동시복용으로 인한 근병증 발생의 상호작용 실마리 정보를 탐색하였다. DPP-4 억제제 단독 복용과 스타틴과의 동시복용을 비교하여 보고 교차비(Reporting Odds Ratio, ROR)를 측정하였으며 결과의 일관성 및 강건성을 확인하기 위해 가법 및 승법위험모형을 사용하였다. 실마리 정보 탐색결과 가법 및 승법위험 모형에서 각각 0 및 1보다 작은 측정값이 산출되어 모두 실마리 정보가 탐색되지 않았다.
가법위험모형은 승법위험모형보다 잠재적인 약물 상호작용을 검색하는데 높은 민감도를 보인다[18]. 이는 가법위험모형에서 실마리 정보 탐색의 낮은 임곗값때문일 수 있다. 약리학적 및 통계학적 복잡성을 고려하였을 때 가법위험모형과 승법위험모형 두 방법을 함께 사용하는 것을 제안하고 있다.
로지스틱 회귀분석 모형
자발적 부작용보고자료에서 약물-약물 상호작용의 실마리 정보를 탐색하기 위한 로지스틱 회귀모형은 Van Puijenbroek et al. [20] 연구에서 제안하였다. 로지스틱 회귀모형은 주어진 데이터셋에서 특정 이상사례가 발생할 확률을 추정하여, 특정 이상사례가 발생할 가능성이 높은 약물-약물이상사례 조합을 찾아내는 방법이다. 로지스틱 회귀모형의 수식은 다음과 같으며, 추정된 두 약물의 상호작용 항(interaction term, β5)의 p-value가 0.05보다 작고 교차비(exp(β5))의 하한값이 1보다 클 때, 실마리 정보로 나타난다.
Netherlands Pharmacovigilance Foundation Lareb은 네덜란드 자발적부작용보고자료에 로지스틱 회귀분석 모델을 적용하여 이뇨제와 비스테로이드 항염증제(non-steroidal anti-inflammatory drugs, NSAIDs)의 상호작용으로 인해 발생할 수 있는 이미 알려진 이상사례를 탐색할 수 있는지 확인하였다. 연구 결과 이뇨제와 NSAIDs의 상호작용 항의 교차비가 2.0 (95% 신뢰구간: 1.1-3.7)으로 나타났다. 두 약물의 상호작용 항의 p 값이 0.05보다 작고 교차비의 하한값이 1보다 크기 때문에 이뇨제와 NSAIDs 상호작용에 대한 실마리 정보가 탐색되었다. 또한, 로지스틱 회귀분석이 시판 후 약물 상호작용에 대한 실마리 정보를 탐색하는데 보다 능동적인 접근 방식이 될 수 있음을 확인하였다[20]. 현재는 로지스틱 회귀모형을 기반으로 응용된 여러 기법들이 사용되고 있다[21-23].
로지스틱 회귀모형은 특정 병용 의약품과 관심있는 이상사례 조합에 대한 실마리 정보를 확인할 수 있으며, 성별, 연령 등의 교란요인을 보정할 수 있고 두 약물의 상호작용 항을 사용하여 세부적으로 분석할 수 있다는 장점이 있다[20]. 그러나 로지스틱 회귀모형은 각 약물의 이상사례 간의 발생할 수 있는 연관성을 고려하지 않고 독립적으로 분석하며 이는 실마리 정보 탐색에서 위양성 또는 위음성의 결과가 나타날 수 있다[24]. 승법위험모형에 기반하는 로지스틱 회귀모형은 이상사례의 발생률이 낮은 경우, 가법위험모형을 이용하는 것보다 연구결과가 왜곡될 확률이 높다는 단점이 있다[25]. 이러한 한계점을 보완하기 위해 경험적 베이지안 접근법(Empirical Bayesian approach)을 이용한 방법이 제안되었다[26].
다항목감마-포아송쉬링커
다항목감마-포아송쉬링커(Multi-item Gamma-Poisson Shrinker, MGPS)는 데이터셋 내에서 여러 항목(예: 여러 약물의 동시 복용과 이상사례) 간의 연관성을 탐색하는 방법이다[27]. MGPS 모형은 감마-포아송쉬링커(Gamma-Poission Shrinker, GPS)모형에서 확장된 모형으로, 현재 실마리 정보 탐색 방법으로 FDA에서 사용하고 있다[26]. 지표값인 EXCESS2는 경험적 베이지안 기하평균(Empirical Bayesian Geo-metric Mean, EBGM)을 통해 도출된다. EBGM은 베이지안 접근법으로 계산된 약물-약물이상사례 조합에 대해 관찰된 보고율과 예상되는 보고율의 비를 말한다[28]. 즉, 특정 이상사례가 발생할 확률이 약물 상호작용과 관련하여 얼마나 증가했는지를 나타내는 지표이다. 실마리 정보를 탐색하는 EXCESS2의 임곗값은 명확하게 정의되어 있지 않으며[26], 실마리 정보를 탐색하는 기준이 되는 임곗값은 연구에 따라 조금씩 다르게 정의되고 있다[29-31].
Almenoff et al. [32] 연구에서 MGPS 방법이 약물 상호작용을 식별할 수 있는지 확인하기 위해 전도장애와 관련된 여러 종류의 심혈관 약물과의 알려진 상호작용을 조사하였다. 베타차단제와 칼슘채널차단제인 베라파밀의 조합에서 전도장애와 관련된 실마리 정보를 확인하였고, 보고율이 낮은 상호작용을 탐색하는 데 있어 MGPS 방법이 보고분율비(Proportional Reporting Ratio, PRR) 및 카이제곱 방법보다 더 효과적이라는 사실을 발견하였다. Muñoz et al. [30] 연구에서는 MGPS 방법을 사용하여 FAERS에서 스타틴과 횡문근융해증 위험이 높은 기타 약물 간의 상호작용에 대한 실마리 정보를 확인하였다. 연구에서 임곗값으로 상호작용 실마리 점수(Interaction Signal Score, INTSS)가 사용되었다. INTSS 값은 약물-약물이상사례 조합의 EBGM 하한값을 약물이상사례 조합의 EBGM 상한값으로 나누어 계산되었다. INTSS 값이 1 이하이면 통계적으로 유의한 상호작용이 없음을 나타내고, 값이 1보다 크고 높을수록 이는 뚜렷한 약물-약물 상호작용이 있는 것으로 정의되었다. 그 결과 클래리스로마이신과 로바스타틴(ITNSS=8.1) 및 심바스타틴(ITNSS=4.6), 사이클로스포린과 로바스타틴(ITNSS=7.1) 및 심바스타틴(ITNSS=5.0)을 함께 사용한 경우 횡문근융해증에 대한 유의미한 실마리 정보를 탐색하였다.
MGPS 방법은 경험적 베이지안 접근법을 사용하기 때문에 특정 약물과 이상사례 조합에 대한 보고가 거의 없을 때, 보고율의 추정치 변동성을 줄임으로써 보다 정확한 추정치를 제공한다는 장점이 있다[33]. 그러나 MGPS 방법을 이용한 예측치는 이상사례의 심각도를 포함하여 다양한 요소의 영향을 받을 수 있으므로, 결과를 해석할 때는 주의가 필요하며 가능한 경우 사례 검토를 통해 타당성을 확보할 필요가 있다[32]. 또한, 3개 이상의 항목 조합을 적용할 수 있으나 개수가 증가할수록 계산량도 함께 증가한다는 단점이 있다[26].
Ω 축소측도모형
Ω 축소측도모형(Ω shrinkage measure model)은 가법위험모형을 기반으로 의심되는 약물-약물 상호작용의 가능성이 있는 일부 보고 패턴을 놓치기 쉬운 로지스틱 회귀모형의 대안으로 제안되었다[12]. 약물 A와 약물 B 복용 후 보고된 이상사례(adverse events, AEs)에 대한 관측값 대기댓값의 비율을 계산하는 불균형 방법으로 데이터베이스에서 두 약물 A와 약물 B를 동시 복용할 때 관심 약물 이상사례 보고는 Table 1와 같이 나타낼 수 있다. 관측된 상대보고율 상대보고율 (
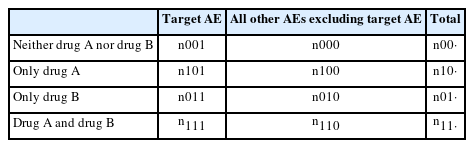
Four-by-two contingency table for drug adverse event reports after concomitant administration of Drug A and Drug B
베이지안 관점에서는 다음 식에 따라 계산하게 되며, q=0.025일 때 추정되는 Ω의 양측검정 95% 신뢰구간의 하한값이 Ω025이다.
빈도주의 관점과 베이지안 관점 각각에서 추정한 Ω025 >0을 약물 상호작용을 탐색하는 임곗값으로 사용한다.
Noguchi et al. [34] 연구는 일본 의약품부작용보고자료(Japanese Adverse Drug Event Report, JADER)를 이용하여 Ω 축소측도모형을 포함한 5개 빈도통계모형(Ω 축소측도모형, 가법위험모델, 승법위험모델, combination risk ratio, 카이제곱 통계모형)의 약물 상호작용 실마리 정보 탐색 알고리즘을 비교하였다. 의심약물로 보고된 모든 약물의 조합과 스티븐스-존슨 증후군(Stevens-Johnson syndrome) 발생의 실마리 정보를 탐색하였으며 Ω 축소측도모형이 가장 보수적으로 실마리 정보를 탐색하는 경향을 보였다. 연구결과 Ω 축소측도모형을 통하여 알로푸리놀-디클로페낙 나트륨, 알로푸리놀-시메티딘 등의 약물 조합을 포함하여 총 712개 조합의 실마리 정보가 탐색되었다. Qian et al. [35]의 연구에서는 상하이 자발적부작용보고자료를 이용하여 약물 상호작용 실마리 정보를 탐색하기 위한 자동화 시스템의 특성과 성능을 설명하였다. 로지스틱 회귀모형, Ω 축소측도모형, 가법 및 승법위험모형이 자동화 탐색을 위해 사용되었다. 세 모형에서 모두 실마리 정보로 탐색된 약물-약물이상사례 조합은 네 가지였으며, 약물 상호작용 실마리 정보 탐색을 위한 유용한 시스템임이 될 수 있다는 것을 확인하였다. 이 연구에서는 Ω 축소측도모형을 이용하여 interferon alfa-2a와 리바비린의 알려진 상호작용인 빈혈 발생을 확인한 결과 측정값이 0보다 큰 1.25로 산출되어 실마리 정보로 탐색되었다.
Noguchi et al. [26]의 연구에서는 Ω 축소측도모형의 보정 매개 변수 α를 0.5로 설정하였으며, 이는 충분한 수축(shrinkage)을 제공하여 1개 또는 2개의 보고로 인한 불균형 보고의 강조를 피할 수 있다는 장점을 가진다. 하지만 이상사례의 발생이 드문 경우, E[f11]의 추정 값이 매우 작게 나타날 수 있고 단일 약물 이상사례로 보고하여 약물-약물이상사례를 선택적으로 과소 보고하는 경우 관찰된 수에 비해 기댓값이 과장될 수 있다. 이때 one-sided 바이어스가 발생하여, Ω 값이 축소될 수 있다는 단점이 있다[26,36].
카이제곱 통계모형
카이제곱 통계모형(Chi-square statistics model)은 특정 약물 병용사용 시 이상사례 발생에 대한 관찰값과 기댓값의 차이를 추정하기 위한 방법으로 카이제곱 검정을 기반으로 한다[37]. 기존 카이제곱 값(χ)은 포아송 모형의 정규 근사를 기반으로 한다[26]. 그러나 이는 보고 수가 적은 경우에는 좋은 근사방법이 아니기 때문에 보정 절차가 필요하다. 이에 따라 잘못된 근사값을 조정하고 위양성의 위험을 피하기 위한 보정 절차를 거쳐 다음과 같은 χ를 제시하였다[37].
일반적으로 χ >2를 두 약물의 동시 사용으로 인한 실마리 정보를 탐색하는 임곗값으로 사용한다.
Gosho [4] 연구에서는 JADER을 이용하여 카이제곱 통계모형과 Ω 축소측도모델을 사용하여 당뇨병 치료제와 항고혈압제 및 항고지혈증 약물의 동시복용 후 저혈당 발생 실마리 정보를 확인하였다. 카이 제곱 통계모형을 사용한 테넬리글립틴과 바니티핀의 약물 상호작용 측정값은 2보다 큰 6.17로 실마리 정보로 탐색되었으며 이외에도 총 19개의 조합의 저혈당 발생과 관련된 당뇨병 치료제-고혈압제 또는 당뇨병 치료제-항고지혈증 약물 상호작용 실마리 정보를 탐색하였다.
Noguchi et al. [34] 연구에서 시뮬레이션 및 방법론 비교 연구 결과, 카이제곱 통계모형의 실마리 정보는 Ω 축소측도모델과 유사한 경향을 보였으며, n111 ≥3일 때 실마리 정보 탐색의 유사도(similarity) 값이 크게 개선되었다. Gosho et al. [37] 시뮬레이션 연구를 통해, 카이제곱 통계 방법은 드문 약물 상호작용에 대한 위양성율을 적절하게 제어할 수 있으며 Ω 축소측도모델에 비해 상대적으로 높은 민감도와 AUC (area under the curve)를 보임을 입증하였다. 그러나 카이제곱 통계모형은 동시복용한 두 약물 중 한 약물에 대한 정보가 누락되어 나머지 약물만 보고될 경우 보고된 약물에서의 상대적 보고율이 과대평가될 수 있다. 이는 Table 1에서 n111의 과소 보고와 n101또는 n011의 과다 보고로 이어지게 된다. 또한 카이제곱 통계모형은 3개 이상의 약물이 있는 약물-약물 상호작용을 고려하지 않는다는 단점이 있다.
고 찰
본 연구에서는 자발적보고자료에 보고된 이상사례 수를 기반으로 약물 상호작용을 탐색하기 위한 5개 통계적 방법론을 설명하였다. 방법론은 빈도주의 및 베이지안 관점에서 분석된다. 가법 및 승법위험모형, 로지스틱 회귀분석 모형, 카이제곱 통계모형은 빈도주의 관점에서 분석되며 다항목감마-포아송쉬링커는 베이지안 관점, Ω 축소측도모형은 빈도주의 관점과 베이지안 관점으로 모두 분석이 가능하다. 단일약물이상사례 조합의 실마리 정보 탐색 방법론에서 빈도주의 관점과 베이지안 관점의 통계법은 각각 장단점을 가지며 여러 비교 연구가 수행되었다. Bonneterre et al. [38] 연구에서는 관찰된 질병과 직업적 노출 사이에 연관성을 탐색하기 위해 약물감시에서 사용되는 불균형 분석 방법을 비교하였다. 빈도주의, 포아송 법칙, 베이지안 관점에서 방법론을 비교하였으며 3개의 방법론에서 특이도는 차이를 보이지 않았고 민감도에서 약간의 차이를 보였다. 베이지안 관점에서 거짓 양성률(false positive rate)이 더 낮았지만 보고 사례수가 증가하게 되면 빈도주의 방법에 대한 이러한 장점은 사라진다. 약물-약물 상호작용 실마리 정보 탐색 연구에서도 유사한 장단점을 보이는 것으로 생각되지만 현재는 검증 연구가 부족하여 각 방법론의 실마리 정보 검색 경향의 유사성과 특이성 검토 연구가 필요하다[26]. 또한 통계 방법론의 민감도 및 특이도를 정확히 측정하기 어려우며 실마리 정보가 적절히 탐색되었는지 확인할 수 있는 표준이 없기 때문에 국내 자발적 부작용자료를 이용하여 여러 방법론을 적용한 시뮬레이션 연구를 제안할 수 있다.
자발적 부작용보고자료는 약물 이상사례 실마리 정보를 검색하고 평가하여 안전성 정보를 생성하는데 활용되고 있다[13]. 현재 약물 실마리 정보 탐색은 대부분 단일약물이상사례 조합에서 이루어지고 있지만 다약제 복용이 보편화되며 약물 상호작용 실마리 정보 탐색 또한 중요성이 높아지고 있다[26]. 그러나 시판 전 임상시험에서는 여러 약물을 복용하는 환자가 제외되기 때문에 약물 간의 상호작용 안전성 감시는 어려운 실정이며 자발적 부작용보고자료를 이용하여 약물-약물 상호작용 실마리 정보를 탐색한 연구 또한 부족한 상황이다[35]. 소개한 방법론 중 일부는 3개 이상의 약물 상호작용에는 적용되지 않으며 대부분에서 길항작용 탐색보다는 상승작용에 초점을 맞추고 있다. 향후 상호작용 연구는 2개 약물 상호작용뿐만 아니라 3개 이상 약물 동시 복용(예: 약물 A-약물 B-약물 C-이상사례 D)의 상호작용 실마리 정보 탐색과 길항작용 탐색 방법론 개발과 연구가 필요할 것이다.
실마리 정보 탐색은 그 특성, 심각성 또는 빈도로 인해 새로운 잠재적인 약물이상반응의 조기 단서를 신속하게 발견할 수 있다는 점에서 약물감시의 첫 단계라고 할 수 있다[39]. 특히 자발적 부작용보고 데이터베이스는 시판 후에 의심되는 약물이상사례에 대한 보고로 현재 시판 후 약물감시에서 중요하다[24]. 자발적 부작용보고자료는 시장 출시에서부터 퇴출까지 의약품의 사용기간 동안 지속적으로 축적된다. 또한 시험 대상자와 치료기간을 제한하는 임상시험과 달리 노인, 임산부 등 취약한 개인을 포함하여 오랜 기간 동안 실제 약물을 사용하는 임상에서 얻은 정보를 제공한다[40]. 자발적 부작용보고자료를 이용하여 실마리 정보를 탐색하는 연구는 이전에 보고되지 않았거나 이전에 보고된 이상사례의 비정상적인 증가를 감지할 수 있다는 장점이 있다[41]. 하지만 이러한 강점에도 불구하고 자발적 부작용보고자료는 몇 가지 한계점을 가지고 있다. 보고된 부작용은 임상시험 및 시판 후 자발적 보고를 기반으로 관찰된 이상사례만 등록하여 특정 약물과 특정 부작용에 대한 인과관계를 명확히 알 수 없으며 특정 약물이 처방된 전체 환자정보를 알 수 없어 특정 부작용의 발생률을 산출할 수 없다[41]. 또한 보고되지 않은 약물 이상사례가 얼마나 되는지, 얼마나 많은 환자가 해당 약물에 노출되었는지 알 수 없다. 이와 같이 보고 건에 대한 보고율 등으로 정량화할 수 있으나 약물과 관련된 이상사례 발생을 정량화하기 어렵다는 단점이 있다[40]. 자발적 보고시스템은 여러 보고 바이어스와 해당 국가의 조사 상황에 영향을 받을 수 있으며, 이상반응의 보고율은 해마다 달라 실마리 정보의 지표값은 조사 시기에 따라 쉽게 변할 수 있다. 자발적 부작용보고자료는 개별 보고서의 데이터 요소 누락, 잘못된 정보 및 중복 보고의 형태로 상당한 질적 및 양적 결함이 있을 수 있다. 다양한 바이어스의 원인은 우연적 연관성을 인과적 연관성으로 보이게 할 수 있기 때문에 관련 전문가의 해석이 필수적이다[42].
국내 의약품안전나라에서는 KAERS에 보고된 자료를 바탕으로 단일 약물 실마리 정보를 탐색하여 공개하고 있으며 결과를 반영하여 의약품 허가사항 변경 조치가 이루어지는 등 규제의사결정에 활용되고 있다[43]. 하지만 약물 상호작용 실마리 정보 탐색 결과는 공개되고 있지 않은 상황이다. 약물 상호작용 실마리 정보 탐색 연구에서 주요 과제는 성능을 평가하기 위한 가이드라인이 없다는 것이며 이는 시판된 약물 상호작용의 안전성 프로파일을 참고할 수 있는 표준이 부족하기 때문이다[44]. 약물 상호작용을 탐색하는 방법론들의 검증과 비교 연구, 자발적 부작용보고자료의 단점을 보완할 수 있는 다양한 데이터베이스에서 적합한 방법론 연구를 통해 약물 상호작용 안전성 분야의 발전과 더욱 정확한 실마리 정보 탐색이 가능할 것이다.
결 론
자발적 부작용보고자료를 이용하여 약물 상호작용 실마리 정보를 탐색할 수 있는 방법론을 소개하였다. 그러나 방법론 간 실마리 정보 탐색 논리 및 임곗값 선택 등이 다양하며, 자발적 부작용보고자료를 이용하여 탐색된 실마리 정보는 인과관계를 파악할 수 없다. 따라서 탐색된 의약품 상호작용 실마리 정보 인과성을 확인하기 위해 다양한 역학 연구방법론 또는 데이터베이스를 이용한 추가적인 연구를 수행할 필요가 있다.
