만성신장질환의 동반질환이 말기신부전으로의 진행에 미치는 영향
Effects for Comorbidities of Chronic Kidney Disease on the Progression to End-stage Renal Disease
Article information
Abstract
Objectives
Due to the aging of population and increase of chronic diseases worldwide, the prevalence of chronic kidney disease (CKD) is on the rise. The increase of CKD is connected to the development of end-stage renal diseases (ESRD) and the occurrence of death caused by ESRD. This study explored the risk factors affecting the progression of CKD patients to ESRD using the sample cohort database built by the Korean National Health Insurance Service.
Methods
This study targeted 2,354 new patients to whom the CKD occurred between 2003 and 2012. The development of ESRD of the CKD patients was checked through the number of cases per 1,000 person years. Significance was confirmed through the t-test and Wilcoxon signed-rank test. For the factors affecting the occurrence of ESRD by risk factor of comorbidities, the Cox proportional hazard regression analysis was carried out.
Results
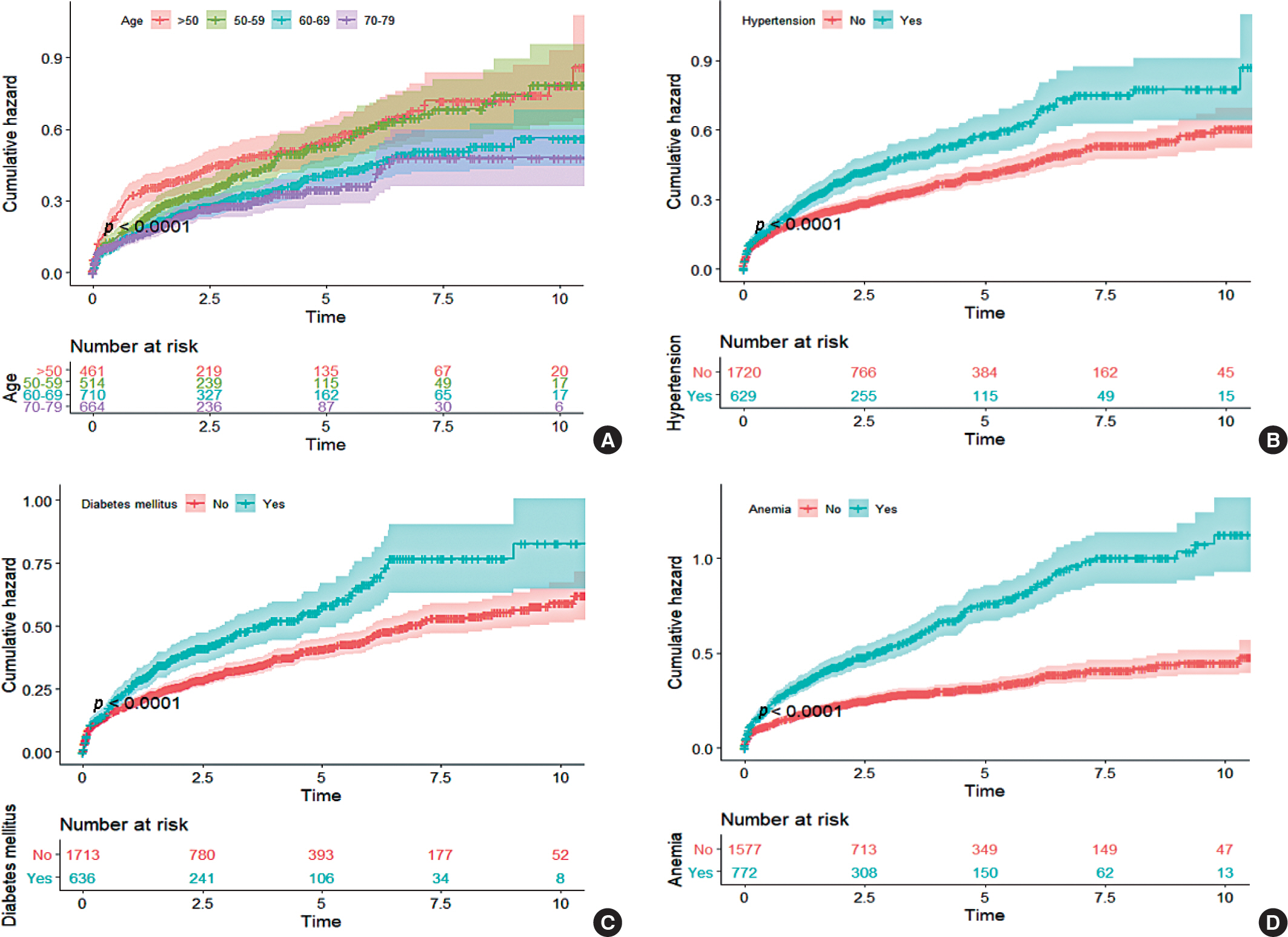
The average routing period of the subjects of this study was 2.98±2.69 years. 105.69 cases of ESRD among CKD patients took place per 1,000 person years during the observation period. The proportional hazard of CKD patients’ ESRD became higher as the subjects’ age became younger (50-59, HR=0.76; 60-69, 0.64; 70-79, HR=0.63), and the proportional hazard was higher from the subjects having proteinuria (Yes, HR=2.16), high hypertension (Yes, HR=1.38), diabetes mellitus (Yes, HR=1.23), and anemia (Yes, HR=1.77) (All p <0.05).
Conclusions
Risk factors for the progression of CKD to ESRD were low age group (less than 60), underweight (less than 23), diabetes, hypertension, and anemia patients. To control the occurrence of ESRD that increases social and economic burdens, along with death risk, it is necessary to establish individualized treatment plans depending on the characteristics and risks of patients based on each type of comorbidity.
서 론
인구의 고령화, 만성질환의 증가로 만성신장질환(chronic kidney disease, CKD)의 유병률 및 사망률이 증가하고 있다. 만성신장질환의 전 세계적인 유병률의 증가는 비만 유병률의 증가와도 무관하지 않다. 2017년 전 세계 만성신장질환자의 유병률은 9.1%이며, 1990년 이후 29.3%의 증가율을 보였다[1]. 2009년 발표된 전국 7개 도시에 거주하는 35세 이상을 대상으로 한 연구에서 만성신장질환 유병률은 13.7%로 나타났다[2]. 사구체여과율이 60 mL/min 이하인 중등도 이상의 유병률은 2018년 남자 3.1%, 여자 1.7%이며, 특히 70세 이상의 고령자에서는 15.1%라는 높은 유병률을 보였다[3].
사구체여과율(estimated glomerular filtration rate, eGFR) 15 mL/min 미만 또는 영구적인 신대체요법(reanl replacement therapy, RRT)이 필요한 상태인 말기신부전(end-stage renal disease, ESRD)은 신장의 기능을 원래대로 회복시킬 수 없는 만성신장질환의 5단계에 해당한다[4]. 만성신장질환이 말기신부전으로 진행하면 개인에게는 사회, 경제, 의료적 위기로서 투석환자의 의료비용은 신장질환이 없는 환자에 비해 10배 이상이며, 말기신부전 환자의 의료비용이 전체 국가의료비용의 3.2-4.1%를 차지하여 막대한 국가 경제적 부담으로 작용하고 있다[5,6]. 말기신부전의 유병률을 보여주는 혈액투석, 신장이식 등 신대체요법 시행 환자는 꾸준히 증가하고 있으며, 2018년 국내 말기신부전 현황은 말기신부전 환자 등록사업을 처음 시작한 1986년 대비 약 40배 이상 증가하였다[3]. 최근 10년간 투석환자는 3배가량 증가하였고 5년 이상 장기 투석환자는 전체에서 46-50%를 차지하고 있다[5,7].
만성신장질환이 말기신부전으로 진행 및 악화된 경우, 암보다 생존율이 낮고 진료비 지출이 커 선진국에선 국가 차원에서 관리 대책을 실시하고 있다[8]. 말기신부전의 주요 원인인 당뇨병이 동반된 말기신부전은 전체 환자의 과반수를 넘었고, 약제사용 및 입원진료로 인한 의료비의 부담이 1.6배 더 높은 것으로 나타났다[9]. 말기신부전 주요 원인의 45-50%를 당뇨병, 25%를 고혈압으로 보고되고 있으나[4,10], 만성신장질환 환자 장기추적 정책용역 연구인 ‘유형별 만성신장질환 생존 및 신기능 보존 장기 추적조사 연구’를 통해 비만과 대사이상, 흡연 등의 위험요인도 밝혀졌다[11]. 만성신장질환 환자 중, 비만 또는 대사이상이 있는 환자에서 말기신부전으로 진행 위험성이 약 1.4배 증가하였다. 또한, 비흡연자에 비해 과거 및 현재 흡연자의 만성신장질환의 악화 위험도가 각각 약 1.7배, 1.8배 증가하였다. 독립적으로 말기신부전의 위험을 높인다는 대사증후군과 기타 다른 질환들과의 연관성 및 그 기전은 밝혀지지 않았다. 또한 만성신장질환 대상자의 건강상태 및 행동, 동반하는 증상과 질환의 위험 인자에 대한 연구가 필요한 상황이다.
따라서 본 연구에서는 국민건강보험공단이 2014년 7월부터 정책 및 학술연구를 위해 제공하고 있는 대규모 청구 데이터를 활용하여 만성신장질환자의 인구사회학적 특성, 신체적 건강상태 및 행동, 동반 증상 및 질환 등이 말기신부전으로의 진행에 영향을 미치는 위험 정도를 탐색하고자 하였다. 이를 통해 만성신장질환자의 궁극적인 치료 목적인 말기신부전으로의 진행 및 악화를 제어하기 위한 개별화된 관리 방안 수립에 기여하고자 하였다.
연구 방법
연구대상 및 자료수집
본 연구는 국민건강보험공단의 연구자용 빅데이터(big data)인 표본 코호트 database (DB)를 이용하였다. 표본코호트 자료는 2002년 건강보험 가입자의 자격 DB로부터 전 국민의 대표성을 유지하기 위해 국민의 2.2% (1,025,340명에 해당)의 표본을 성별, 연령별, 소득 수준별로 층화 표본 추출한 자료이다[12]. 여기에는 사회, 경제적 변수(성, 연령, 거주지, 소득수준 등)와 통계청 자료를 연계해 사망연월, 사망원인 코드로 구성된 ‘자격 DB’와 건강검진결과 및 문진(건강행태)자료로 구성된 ‘건강검진 DB’, 상병과 처방정보를 포함한 진료 청구 내역으로 구성된 ‘진료 DB’, 요양기관 정보가 포함된 ‘요양기관 DB’로 구축되어 있다[13].2003년부터 2012년에 최소 1회 이상 ICD-10 기준 N18.N18.X (N18, N18.1, N18.2, N18.3, N18.4, N18.5, N18.9)로 청구된 환자는 6,309명으로 분석되었다. 본 연구의 대상자 선정 및 제외기준에 따라 선정된 총 연구대상자 수는 2,354명이다(Figure 1).
연구도구
만성신장질환
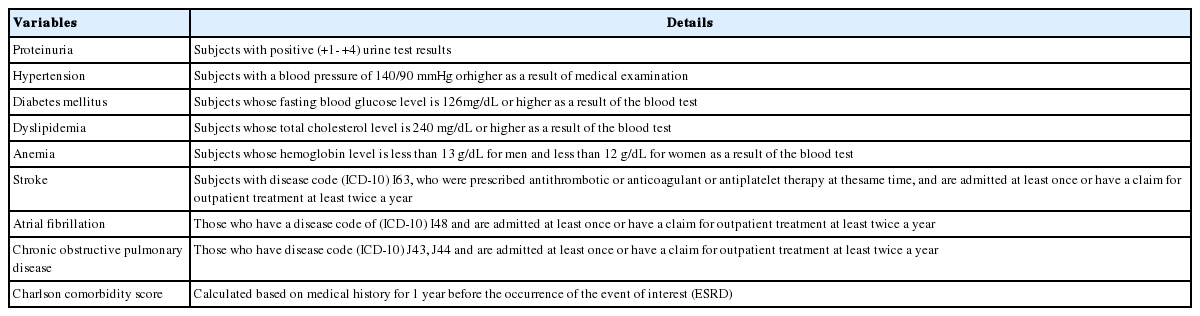
본 연구의 대상자인 만성신장질환은 국제질병분류 제10차 개정판(International Classification of Diseases, ICD-10) 기준 ‘ N18 (만성 신장병), N18.1 (만성 신장병;1기), N18.2 (2기), N18.3 (3기), N18.4 (4기), N18.5 (5기), N18.9 (상세불명의 만성 신장병)’로 청구된 환자 중 신대체요법(혈액투석, 복막투석, 신장이식) 코드가 없이 입원 진료 1회 이상 또는 외래진료 2회 이상 청구된 환자로 정의하였다[14,15]. 만성신장질환을 처음 진단받은 환자를 대상으로 하기 위해 기준년도(만성신장질환 발생년도) 이전 ICD-10 코드 ‘ N18 (만성신장병), N19 (상세불명의 신부전), I12 (고혈압성 신장병), I13 (고혈압성 심장 및 신장병), E10.2 (신장합병 증을 동반한 1형 당뇨병), E11.2 (신장합병증을 동반한 2형 당뇨병), E13.2 (신장합병증을 동반한 기타 명시된 당뇨병), E14.2 (신장합병증을 동반한 상세불명의 당뇨병)’ 및 신대체요법이 청구된 환자는 제외하였다.
말기신부전
말기신부전은 ICD-10 기준 ‘ N18, N19, I12, I13, E10.2, E11.2, E13.2, E14.2’와 신대체요법 수가코드(혈액투석 ‘ O7011-O7020’, 복막투석 ‘ O7071-O7075’, 신장이식 R3280)가 함께 청구된 첫 시점을 발생일로 정의하였다[16].
동반질환
Table 1은 본 연구에서 독립변인으로 사용된 증상 및 동반질환에 대한 변수의 조작적 정의이다. 단백뇨, 고혈압, 이상지질혈증 및 빈혈은 건강검진 결과치를 기반으로 대상자를 추출하였으며, 뇌졸중, 심박세동 및 만성폐쇄성폐질환은 ICD-10 질병코드 및 입원, 외래 진료 등의 청구 데이터를 기반으로 추출하였다(Table 1).
Charlson Comorbidity Index (CCI)
CCI는 의무기록조사 자료를 기반으로 유방암 환자의 1년 사망률을 예측하기 위하여 만들어진 동반상병 측정도구이다. 총 22개의 질병에 가중치를 두어 합산하는 방식으로 심근경색(myocardial infarction) 등의 질병에는 1점의 가중을, 당뇨합병증(diabetes with chronic complications) 등에는 2점, 심각한 간질환(severe liver diseases)에는 3점, 에이즈(AIDS/HIV)는 6점의 가중을 부여한다[17]. 관찰기간 내 해당 동반질환에 대한 ICD 코드 출현 시 점수를 부여하였다. CCI는 관심사건 발생 이전 1년간의 의료기록 내역을 기반으로 연산하였다.
연구모형
코호트 진입 후, 만성신장질환 발생년도를 기준으로 동반질환의 측정 기간은 1년 이전으로 정의하였다. 만성신장질환 진단 이전에 동반질환을 가지고 있는 대상자를 포함하였으므로, 연구대상자는 기준년도 시점에서 말기신부전으로의 악화 요인으로써의 영향력을 알아보기 위해 Figure 2와 같이 연구모형을 설계하였다.
분석 방법
본 연구는 만성신장질환자의 말기신부전증 발생 시간을 관찰하였다. 관찰시간은 만성신장질환 첫 진단일로부터 관심사건의 첫 발생일, 관찰이 중단된 날 또는 관찰 종료 시점으로 정의하였다. 연구대상자의 일반적 특성을 탐색하기 위하여 카이제곱 검정(Chi-squared test) 및 t-test를 시행하였다. 만성신장질환자의 말기신부전증 발생까지의 관찰기간을 추적하였으며, t-test와 윌콕슨 부호순위 검정(Wilcoxon signed rank test)으로 유의성을 확인하였다. 만성신장질환자의 말기신부전증 발생에 영향을 끼치는 위험인자별 비례위험을 평가하기 위해 콕스의 비례위험 회귀분석(Cox proportional hazard regression analysis)을 시행하였다. 만성신장질환자의 말기신부전의 누적발생률은 캐플란-마이어 분석(Kaplan-Meier method)을 통해 비교하였다. 본 연구의 분석은 통계 패키지 R 4.0.0으로 수행하였다.
연구 결과
연구대상자의 특성
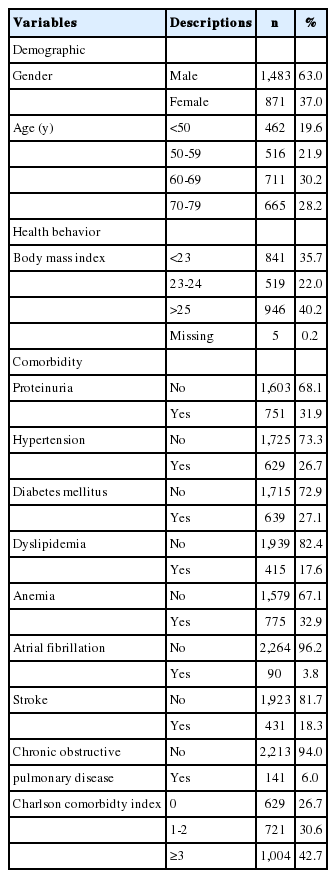
연구대상자로 선정된 2,354명의 특성은 Table 2와 같다. 연구대상자 중 남성이 1,483명(63.0%)이며, 60-69세의 연령은 711명(30.2%)이다. 체질 량지수(body mass index, BMI)가 비만에 해당하는 25 kg/m2 이상인 대상자는 946명(40.2%)으로 나타났다. 단백뇨가 양성인 대상자는 751명(31.9%)이었다. 고혈압을 동반한 경우는 629명(26.7%), 당뇨는 639명(27.1%), 이상지질혈증은 415명(17,6%), 빈혈은 775명(32.9%)이었다. 심방세동을 동반한 대상자는 90명(3.8%), 뇌졸중은 431명(18.3%), 만성폐쇄성폐질환은 141명(6.0%)이었다. CCI는 3점 이상의 대상자는 1,004명(42.7%), CCI 0점에 해당하는 대상자는 629명(26.7%)이었다(Table 2).
대상자 특성과 동반질환에 따른 차이
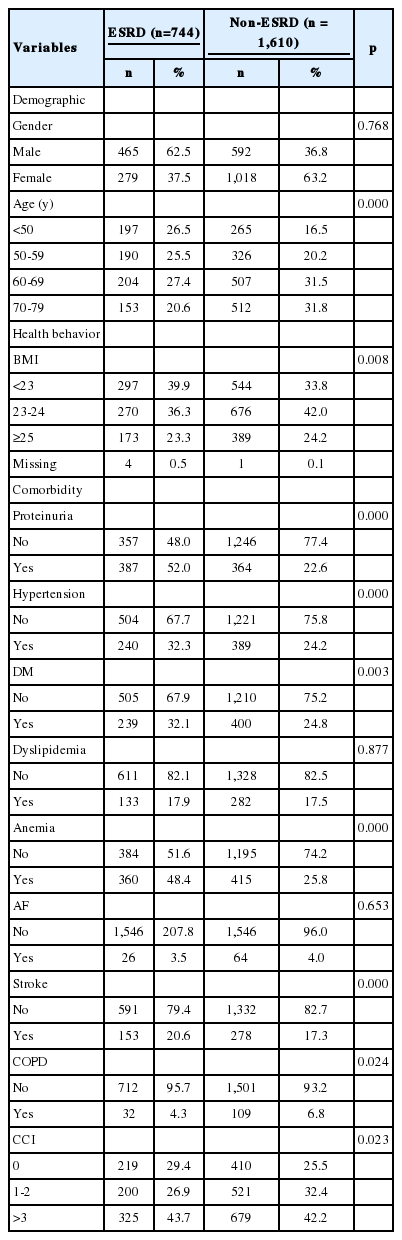
총 연구대상자 2,354명의 평균 추적기간은 6,560.15인년(2.98±2.69년)이었다. 말기신부전증 발생자는 744명(31.6%), 미발생자는 1,610명(68.4%)이었다. 연령(p =0.000), BMI (p =0.008)와 단백뇨(p =0.000), 고혈압(p =0.000), 당뇨(p =0.003), 빈혈(p =0.000), 뇌졸중(p =0.000), 만성폐쇄성폐질환(p =0.024), CCI (p =0.023)가 말기신부전 발생과 관련되는 것으로 나타났다(p <0.05) (Table 3).
만성신장질환자의 말기신부전증 발생 위험비
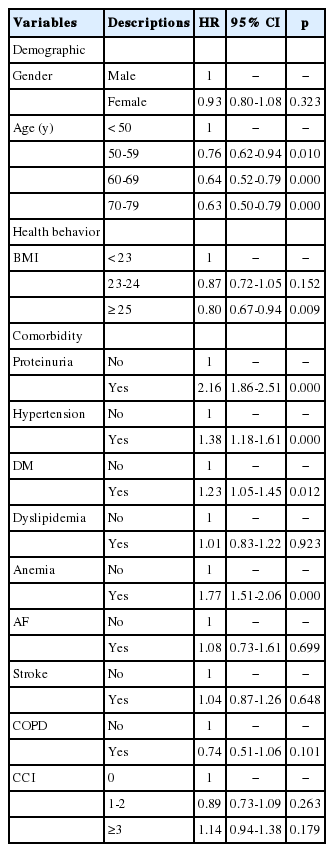
만성신장질환자의 말기신부전증은 1,000인년(Person-year)당 105.49건이 발생하였으며, 말기신부전 발생까지의 평균 관찰기간은 1.44±1.87인년, 중앙 관찰기간은 0.66인년이었다. 만성신장질환자의 말기신부전증으로의 진행 위험에 대한 분석 결과, 위험인자는 연령, BMI, 단백뇨, 고혈압, 당뇨, 빈혈이 통계적으로 유의하였다(p <0.05). 연령에 따른 비례위험은 연령이 낮을수록 높았으며(50-59세 hazard ratio, HR= 0.76; 95% confidence interval, 95% CI=0.62-0.94, p =0.010; 60-69세 HR=0.64, 95% CI=0.52-0.79, p =0.000; 70-79세 HR=0.63, 95% CI= 0.50-0.79, p =0.000), BMI가 25 이상인 비만 대상자는 23 미만 저체중 대상자에 비해 약 0.8배(95% CI=0.67-0.94, p =0.009) 낮았다. 단백뇨가 있는 대상자는 단백뇨가 없는 대상자에 비해 약 2.2배(95% CI= 1.86-2.51, p =0.000) 높았다. 고혈압이 있는 대상자의 비례위험은 약 1.4배(95% CI=1.18-1.61, p =0.000) 높았으며, 당뇨는 약 1.2배(95% CI=1.05-1.45, p =0.012), 빈혈은 약 1.8배 (95% CI=1.51-2.06, p =0.000)로 높은 위 험도를 보였다. CCI는 0점인 대상자에 비해 CCI 점수가 3점 이상일 때 약 1.1배(95% CI=0.94-1.38, p =0.180) 높았으나 통계적으로 유의하지는 않았다(Table 4).
만성신장질환자의 말기신부전 누적발생률
연령에 따른 만성신장질환자의 2년 이내 말기신부전 누적발생률은 50세 미만 대상자에서 32.6%, 4년 이내 누적발생률은 40.0%로 가장 높았으며, 연령이 높을수록 발생률이 낮았다. 고혈압의 경우, 2년 이내 말기신부전 누적발생률은 31.3%, 4년 이내 누적 발생률은 41.0%이었다. 당뇨는 2년 이내 말기신부전 누적발생률은 31.6%, 4년 이내 누적발생률은 40.7%이었다. 빈혈은 2년 이내 말기신부전 누적발생률은 39.8%, 4년 이내 누적발생률은 52.6%이었다(Figure 3).
고 찰
전 세계적으로 5억 명(성인 10명 중 1명)에 이르는 사람들이 신장질환을 가지고 있으며, 150만 명 이상이 말기신부전으로 투석이나 신장이식을 통해 삶을 유지하고 있다[6]. 2016년 건강보험통계 연보에 따르 면 만성신장질환 환자수는 2009년 9만 명에서 2016년 19만 명으로 늘어나 7년간 10만 명이 증가하였으며, 단일상병 기준 진료비 상위 2위 (1조 6,914억 원)를 차지할 정도로 의료비 지출 규모가 크다[18]. 또한, 대한신장학회 말기신부전 환자 등록사업 결과에 의하면 2016년 투석이나 이식을 받은 말기신부전 환자 수는 94,000명에 이른다[6].
노인 인구의 급증에 따른 신장질환 환자의 증가로 이들 질환의 유병률, 위험인자분석 및 관련 질환과의 연관성에 대한 연구 요구가 증가하고 있으나 관련된 연구는 고혈압 및 당뇨 질환에 국한되어 다른 동반질환 또는 동반질환의 중증도에 따른 적절한 관리 대책이 어려웠다. 만성신장질환 환자에서 말기신부전으로 진행을 예측하기 위한 임상적 알고리즘은 단백뇨와 혈청 크레아티닌(creatinine) 검사에만 의존하고 있으며 비용효과나 예측도에 대한 검토가 거의 없는 실정이다.
이에 본 연구는 만성신장질환의 말기신부전증으로의 진행에 영향을 미치는 위험인자를 대상자의 동반질환의 관점에서 탐색하였다. 만 성신장질환자의 말기신부전으로의 진행에 유의한 위험인자는 연령, 체질량지수, 단백뇨, 고혈압, 당뇨, 빈혈로 분석되었다.
연령은 만성신장질환자의 말기신부전 발생에 유의한 결과를 보였다. 선행연구 결과에 따르면 만성신장질환자의 말기신부전 발생은 연령이 낮을수록 비례위험이 높으며[19,20], 본 연구에서도 만성신장질환자의 말기신부전 비례위험은 연령이 낮을수록 높았다. 누적발생률 분석 결과 말기신부전의 2년 이내 발생률은 연령이 낮을수록 높았다. 50세 미만의 낮은 연령에 만성신장질환을 진단받은 환자는 좋은 삶의 질 영위를 위해 말기신부전으로의 진행 및 악화를 제어하기 위한 적극적인 치료가 필요하다.
체질량지수가 낮을수록 말기신부전으로의 비례위험이 0.8배 낮았다. 2009년부터 2017년까지 20세 이상 한국인 1,000만 명을 대상으로 8년간 추적 조사한 결과, 저체중이 당뇨병 환자의 말기신부전 위험도를 60% 높이는 강력한 요소임이 나타났다[21]. 투석을 받지 않은 약간 진행된 신부전환자 환자 376명을 추적 관찰하였을 때 체질량지수가 가장 낮은 4분위수군과 가장 높은 4분위수군에서 높은 사망률을 나타냈고 다른 동반질환이 없는 환자만 따로 분석하였을 때 비만은 생존율에 나쁜 영향을 주었고 위험도는 1.5배로 증가하였음을 보고하였다[22,23].
고혈압은 만성신장질환의 원인이자 말기신부전으로 이행시키는 위험요인으로 알려져 있다[24,25]. 본 연구결과에서도 고혈압을 가진 만성신장질환자의 말기신부전증 발생 비례위험과 누적발생률이 유의하게 높았다. Li et al. [26]의 연구결과에 따르면 만성신장질환을 가진 고혈압 환자 중 수축기 혈압 145 mmHg 이상인 경우 만성신장질환의 악화가 유의하게 높았다. 따라서 고혈압을 가진 만성신장질환 환자의 말기신부전 발생 위험을 낮추기 위한 혈압 관리가 강조된다.
말기신부전의 원인으로 당뇨병이 차지하는 비율은 1992년에는 20% 수준에 그쳤으나 2015년에는 48.4%로 증가하였다[10]. 사구체신염에 의한 말기신부전증 발생증가 추세가 둔화된 반면, 당뇨병성신증에 의한 말기신부전증의 발생은 연령이 증가하면서 둔화되지 않거나 오히려 증가하는 추세를 보이고 있다[27]. 본 연구결과에서도 당뇨를 동반한 만성신장질환자의 말기신부전증 발생 비례위험과 누적발생률이 유의하게 높았다.
빈혈은 혈액 내에 적혈구가 부족한 상태를 말하며, 혈액 내의 적혈구 수나 혈색소 수치 검사를 통해 진단한다[28]. 빈혈은 만성신장질환의 흔한 합병증으로 신장기능이 감소할수록 빈혈의 유병률이 증가한다[29,30]. 본 연구결과, 빈혈을 가진 만성신장질환자의 말기신부전 발생 위험비가 높았으며 통계적으로 유의하였다. 덴마크의 대규모 인구 기반 코호트 연구[31]에서는 빈혈이 있는 만성신장질환자의 말기신부전 비례위험은 1.27-1.91배 높다는 결과를 보고하였다. 이는 본 연구의 다변수로 보정한 말기신부전의 비례위험 1.77배와 유사한 결과이다. 빈혈은 적절한 치료를 통해 관리가 가능하기 때문에 말기신부전 예방을 위해서는 만성신장질환 진단 초기부터 적극적인 빈혈 관리가 필요하다.
당뇨병, 고혈압 환자가 지속적으로 단백뇨가 나오면 만성신장질환이 있음을 시사한다[32]. 본 연구결과에서 단백뇨를 가진 만성신장질환자는 말기신부전증으로의 진행 및 악화의 위험요인으로 비례위험과 누적발생률이 유의하게 높았다.
본 연구는 만성신장질환의 말기신부전증으로의 진행에 영향을 미치는 위험인자를 대상자의 동반질환의 관점에서 탐색하기 위해 건강검진 및 청구자료를 활용한 대규모 인구 기반의 연구라는 강점을 가진다. 또한 사회인구학적 변수 및 건강관리 행동 변수뿐만 아니라, 대상자의 동반질환과 동반질환 중증도 변수에 따른 만성신장질환의 말기신부전증으로의 진행에 대해 다각도 측면의 분석을 통해 발생률과 발 생 비례위험을 평가하여 환자 특성과 그 위험도에 따라 개별화된 치료계획 수립에 기여할 수 있다는 의의를 가진다.
이러한 연구의 의의에도 불구하고 본 연구는 다음과 같은 제한점을 가진다. 첫째, 미국신장재단과 국제신장학회의 만성신장질환 정의는 콩팥 손상이 3개월 이상 지속되거나, 콩팥 손상 유무와 관계없이 3개월 이상 혈청 크레아티닌으로 추정한 사구체여과율이 60 mL/min/1.73 m2 미만으로 감소된 상태를 말한다[33]. 그러나, 본 연구에서는 ICD-10 코드 기준의 진단정보를 활용하여 만성신장질환을 정의하였다. 건강검진 실시기준 제정∙고시에 따라 국민건강보험공단의 표본코호트 DB의 혈청 크레아티닌 결과 정보는 2008년부터 축적되었기 때문이다[34]. 본 연구에서는 이러한 제한점을 극복하고 진단의 정확성을 높이기 위해 ICD-10 코드 외 입원 및 외래 방문 횟수를 고려하였다. 둘째, 고혈압, 당뇨, 빈혈, 이상지질혈증의 임상의의 진단과 약물 복용력을 반영하지 못했다. 이는 해당 동반질환에 따른 발생 위험이 과소평가 될 위험이 있다. 그러나 검사결과로 변수를 정의함으로써 약물복용에도 불구하고 해당 질환이 조절되지 상태를 반영하여 위험도를 추정하였다는 의의가 있다. 셋째, 본 연구에서 활용한 데이터베이스는 만성신장질환자 연구용 맞춤형 표본코호트가 아닌 전국민의 2.2%의 표본에 해당하는 자료이기 때문에 연구대상자의 수와 평균 추적 관찰기간이 충분히 길지 않았다. 향후의 연구에서는 만성신장질환자의 맞춤형 코호트 연구가 필요하다.
결 론
만성신장질환의 말기신부전으로의 진행 및 악화는 연령이 낮을수록 저체중일 때 위험이 높았으며, 당뇨 및 고혈압뿐만 아니라, 빈혈을 동반한 대상자들에게 발생 위험비율이 높았다. 국내에서는 당뇨, 암, 심뇌혈관질환 등과 달리 만성신장질환에 대한 예방 프로그램이 활성화되지 않은 실정이다. 사회경제적 부담 증가와 사망위험을 높이는 말기신부전의 발생 억제 및 생존율 향상을 위해 각 위험인자, 고위험군에 대한 검진과 체계적이고 포괄적인 예방 및 관리 대책이 필요하다.
Acknowledgements
This study was supported by a grant from the Gachon University for Excellent Researcher Support Project (GCU-2018-0352).
Notes
No potential conflict of interest relevant to this article was reported.