Patient Drug Database: 환자 생성 건강 데이터를 활용한 환자 주도적 약물 부작용 탐색을 위한 데이터베이스 구축
Patient Drug Database: Construction of Database for Patient Leading Drug Side Effects Exploration Using Patient Generated Health Data
Article information
Trans Abstract
Objectives
This study focuses on building a database for patient-led search on drug side effects using basic drug information, drug analysis results information, patient information, and patient-generated health data (PGHD).
Methods
After collecting data from the Health Insurance Review and Assessment Institute, the Korean Pharmaceutical Information Center, the Ministry of Food and Drug Safety, and the Korean Pharmaceutical Association, basic drug information was created. By utilizing the Korea Average Event Reporting System (KAERS) side effect report data provided by the Korea Drug Safety Administration and MetaLAB, a drug side effect detection algorithm applied on the Konyang university hospital's real data, we designed and built a database using Oracle DB, which contains a table of patient information and PGHD. For drug information, a total of 49,553 drugs were mapped, and drug analysis results used KAERS and MetaLAB.
Results
Based on the collected drug information, a total of 15 tables containing basic drug information (7 tables), drug analysis results (2 tables), patient information (1 table), and patient generation information (5 tables) were created using EDI codes, following mapping and normalization. Basic drug information included 49,553 EDI and 2,099 ATC codes. Drug analysis results included 2,046 KAERS ATC codes, 1,701 WHOART-ARRN (PT) that the result of 33 WHOART-SEQ (IT), 15,861 MetaLABEDI codes, and 101ATC codes. The ADR results were constructed using 62 DRUG_IDs and 73 MedDRA_PTI_IDs.
Conclusions
The Patient Drug Database (PD2B) in this study was employed to allow patients to voluntarily report on their perception and drug side effects through application tools, which can provide quick measures against drug side effects and assist in the discovery of new ones.
서 론
“약물 부작용”(Drug Side Effects)은 우리가 생각했던 약효가 아니라, 의도하지 않게 나타난 부가적인 작용을 말한다. 예를 들어, 감기약 중 콧물을 치료하는 작용과 동시에 졸린 기분을 느끼게 하는 작용이 일어날 수 있는데, 이때 콧물을 멈추는 것을 ‘약물 주작용’, 잠이 오는 작용을 ‘약물 부작용’이라고 한다[1].
한 번 부작용이 일어난 약물은 재차 복용 시 더 심각한 반응이 나타 날 수 있어 과거 한 번이라도 부작용이 발생했던 약의 정보를 환자와 의료진은 기억해야 하며 한 번 이상 부작용이 발생했던 약물은 환자와 의료진의 약물 이상반응 보고를 통해 유해 약물 이상반응 카드 등의 적절한 조치를 받을 수 있다. 이 조치는 환자의 의약품 부작용 재발을 막고, 약물 처방 시 환자의 권리가 증진되고, 의료진에게 유해사례정보를 제공하여 치료 과정의 개선에 도움을 준다[2].
선행연구에서는 환자에 의한 약물 부작용 보고가 의료진의 약물 부작용 보고와 유사함으로 신뢰도가 있다는 결과[3]와 환자의 약물 부작용 보고가 의료진보다는 약물이상반응(adverse drug reactions, ADR)의 영향에 중점을 둔 보고라는 점[4]과 환자의 약물 부작용 보고가 새로운 약물 부작용을 식별한다는 연구 결과가 있다[5]. 하지만, 대부분의 약물 부작용 보고는 의료진에 의해서 보고되고 있는 상황이며[6,7], 국내 환자의 경우 약물 부작용 보고율은 10%도 미치지 못한다[8].
또한, 일반인 스스로 약물 부작용 보고에 대한 인식이 10명 가운데 1명에도 미치지 못할 만큼 약물 부작용 자발적 보고에 대해 인식이 부족한 실정이며[9] 따라서, 환자 약물 관리 개선에 도움을 줄 약물 부작용 보고의 필요성이 대두된다[10].
국내 자발적 보고 시스템으로는 대표적으로 한국 의약품 안전관리원에서 제공하는 의약품이상사례보고시스템(Korea Adverse Event Reporting System, KAERS) [11]이 있다. 시판 전 임상 시험에서 미처 파악하지 못한 부작용을 발견하고, 드물게 발생하는 약물 시판 후 유해 반응을 조기에 발견하는 장점이 있는데 이를 위해 의사, 약사 및 환자 스스로가 복용한 약물과 의심되는 유해 사례를 행정 당국이나 관련 약물 감시 센터 등에 신고하는 시스템이다[12]. 하지만, 일반인 및 환자가 KAERS의 실제 자료 활용이 난해하고 이 자료를 쉽게 이해시켜 줄 수 있는 방안도 부족한 현실이다[13].
미국의 경우 의료진과 환자가 자발적으로 약물 부작용 보고에 참여하며 제약 회사를 통해 미국식품의약품안전국(Food and Drug Ad-ministration, FDA)에 보고하고 있으며[14], 1993년부터 보고 과정을 간소화하고자 MedWatch 프로그램을 활용하여 환자가 이용하기 쉽게 하였다[15]. 영국에서는 의료진의 보고만으로는 유해 반응을 모두 판단하기 어려워 자발적 부작용 보고 제도인 Yellow Card Scheme를 활용하여 약물 유해 사례를 환자가 스스로 약물 유해 사례를 보고하도록 운영하고 있다[16,17]. 최근, 기존 전화, 팩스, 이메일 등의 보고 과정을 간소화하고자 앱(application, App)을 사용한다. 대표적으로는 YELLOW CARD [18], LAREB [19], HALMED [20], VigBIP [21]등의 앱이 있다. 예시로, VigBIP 앱(6.7%)을 활용하여 기존의 보고 방법(3.4%) (전화, 이메일, 팩스, 편지, 웹사이트)보다 활용 빈도수가 높게 나타났다. 그 이유는 다른 기존 보고 방법보다 활용하기 용이하다는 점이 있어 앱을 사용하였다. 이처럼 자발적 보고 앱을 활용한다면 약물 부작용에 대한 안전 문제의 개선에 도움을 줄 것으로 사료된다. 그렇지만 선행 출시된 앱들은 실제 환자의 약물 부작용 분석 등을 알려주지 않아, 이에 우리는 실제 환자의 약물 부작용 분석 결과가 담긴 자료를 활용하고자 한다.
모바일 앱을 개발하기에 앞서 중요한 것은 관련 자료의 입력과 검색에 체계적으로 활용될 데이터베이스 구축 안을 마련하는 것이다. 기존의 국내 약물 데이터베이스로는 식품의약품안전처와 건강보험심사평가원을 활용한 약학정보원 등의 데이터베이스가 있다. 약학정보원 데이터베이스에는 약물 기본정보(성분명, 제품명, 의약품안전성정보 등)만이 제공되기 때문에, 환자들의 자발적 부작용 인식을 위해 실제 환자의 약물 부작용 분석 결과가 담긴 자료도 활용하여 DB를 구축한다면 앱 연동 등을 통해 자발적 보고에 용이할 것이라고 판단되어 이를 목표로 하였다.
최근에는 융복합 제품이 등장하며 스마트폰, 웨어러블 디바이스(wearable device) 등의 발전으로 환자가 병원에 가지 않더라도 측정하고 저장할 수 있는 환자 생성 건강 데이터(patient-generated health data, PGHD)를 활용할 수 있는 방법을 모색했다[22,23]. 또한, PGHD에는 자체 보고된 건강 및 치료기록, 환자 보고 결과 및 생체 인식 센서 등이 포함되어 환자와 의료진의 의사소통 개선 및 원격 증상 모니터링을 통한 적절한 치료가 가능하다[24]. 이 적절한 개입으로 의료진이 놓칠 수 있는 정보 파악 및 조기 조치로 인한 환자 건강의 질이 상승한다.본 연구의 특징은 환자의 자발적 약물 부작용 보고가 약물 감시에 부정적이지 않다는 결과와 환자가 생성한 데이터가 약물 감시 DB를 통해 예기치 않은 부작용을 발견한 선행연구 결과[25–27]를 토대로 환자 생성 테이블을 만들어 환자 주도적 약물 부작용 보고 데이터를 확보하여 데이터베이스 상에 저장 및 관리를 하고자 하는 것이 특징이다.
연구 방법
연구자료
약물 기본정보
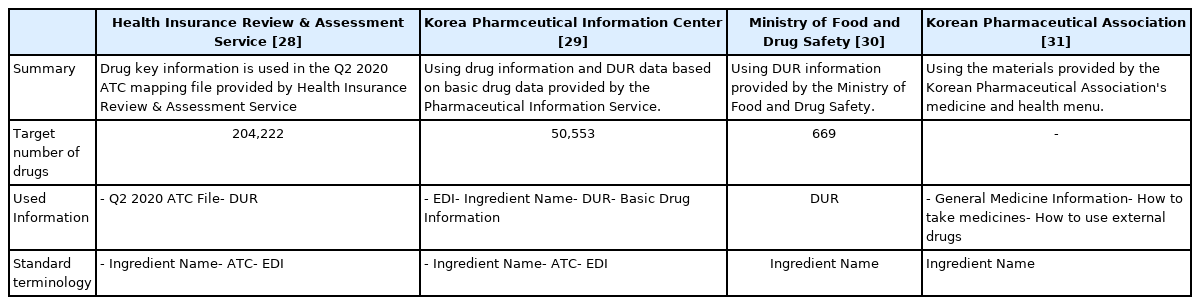
본 연구는 4개의 기관(건강보험심사평가원[28], 약학정보원[29], 식품의약품안전처[30], 대한약사회[31]) 데이터를 수집하였다.
• 건강보험심사평가원: 의약품 관리 종합 정보 포탈 내 의약품 정보검색 메뉴에서 2020년 2분기 ATC 파일에서 204,222개의 약물 자료를 수집하였다.
• 약학정보원: 약학정보원 포탈 내에서 제품명, 성분/함량, 전문/일반, 제조/수입사, 제형, 성상, 허가일, 급여정보, ATC코드(Anatomi-cal Therapeutic Chemical Classification System), 식약처분류, KPIC 약효분류, 의약품안전성정보, 포장단위, 저장방법 등의 기본적인 약물 정보와 효능 ∙효과, 용법∙용량, 주의사항, 복약정보의 허가정보, 복약정보의 자료를 수집하였다.
• 식품의약품안전처: 식품의약품안전처 포탈 내에서 제공하는 특정연령대 성분(207개), 노인주의 성분(61개), 용량주의(356개), 투여기간주의 성분(45개)의 669개 약물도 추가적으로 환자에게 약물 부작용 정보를 알려줄 수 있도록 수집하였다.
• 대한약사회: 대한약사회 포탈 내 ‘약과건강’이라는 메뉴에서 일반의약품 안내, 의약품 복용법, 외용약 사용법 3개의 카테고리를 활용하였다. 일반의약품 안내는 소화기관약, 감기약, 외용제, 비뇨생식기약, 안∙이∙비∙치과약, 자양강장제, 신경정신과, 치질약, 알레르기, 임신진단 시약, 구충약, 멀미약, 한약(생약)제제, 가정상비약 등 담겨 있으며, 약에는 처방전이 필요한 약과 필요 없는 약에 대해 알려준다. 의약품 복용법은 어린이 약 먹이기, 임신과 약품 복용 1, 임신과 약품 복용 2, 올바른 복용방법, 복약 시음 용수, 내복약 복용법, 정제(알약)복용법의 약에 대한 포괄적인 복용법에 대해 알려주며, 외용약 사용법은 점이제(귀약), 안약∙안연고, 항문좌약, 질좌약, 흡입약, 코약, 패치제, 기타 외용제의 외용제 약에 대한 사용법을 알려 준다. 특정 약물만이 아닌 포괄적인 약물에 대한 설명을 알려주고자 대한약사회 자료를 수집하였다.
앞서 기술된 자세한 설명은 Table 1에 정리하였다.
약물 부작용 분석 결과
본 연구에서는 기존에 제공되는 기본적인 약물 정보(성분명, 제품명, 약물안정성정보 등) 외 환자가 복용한 약물의 부작용 인지에 도움이 되는 추가적인 정보 중 주요 의료 정보 데이터를 기반으로 통계 기법을 활용한 부작용 분석 결과를 수집하였다. 이 분석 정보는 실제 환 자들의 약물 부작용 분석 결과로서 환자가 약물에 대한 정보와 부작용의 경각심을 갖는데 도움을 줄 것이다.
연구에서 활용한 분석 정보는 전자의무기록 기반 부작용 알고리즘 MetaLAB [32,33]과 자발적 보고 기반 부작용 시스템인 KAERS [11]를 활용하였으며, 건양대학교 기관생명윤리위원회의 승인(IRB No.: 2018-09-012, 2019-08-018)을 받았다.
• MetaLAB: 전자의무기록의 진단 검사 데이터와 간호 데이터를 활용한 약물 부작용 탐지 알고리즘인 MetaLAB [32,33]을 활용하였으며, 그중 건양대학교 병원 실제 약물 부작용 정보를 담고 있는 약물 부작용 분석 결과를 수집하였다. MetaLAB은 전자의무기록 상 부작용 주의 101개 성분의 약물에 대해 77가지 부작용의 LAB 수치를 세분화하여 약물 복용 후 특정 LAB 수치의 변화량에 따라 부작용을 판별한다. 따라서 약물 기본 정보 약물 중 부작용 주의 101개의 약물과 교집합을 이루는 약물에 대해서는 ATC코드를 기준으로 매핑(mapping)한다. 이를 통해 환자는 데이터 기반 부작용 정보를 제공받는다.
• KAERS: 의약품 등 투여 후 이상 사례(부작용)가 발생하였을 때 이에 대한 정보를 보고 할 수 있도록 구축된 시스템이다. 우리는 KAERS [11] 데이터베이스 안의 KIDS-KD자료의 변수 레이아웃에서 필요한 기본정보, 의약품 정보, 부작용 정보 등의 테이블과 구체적인 변수로는 환자성별, 연령, 보고유형, 의심병용구분, 부작용코드, 부작용 경과 등을 활용하여 특정 약물에 의해 발생한 유해 사례의 교차비(odds ratio, OR)를 그 약물을 제외한 다른 약물로 인해 발생한 유해 사례의 교차비로 나눈 reporting odds ratio (ROR) [34]과, 다른 약물을 복용하는 환자에 대해 동일한 부작용이 보고되는 빈도와 비교하여 특정 약물을 복용하는 개인에 대해 특정 부작용이 보고되는데 사용되는 통계(proportional reporting ratio, PRR) [35] 등 각 약물별 분석 결과 테이블을 제시하였다.
데이터베이스 항목 설계
본 연구의 데이터베이스 설계 과정은 다음과 같다(Figure 1). 데이터베이스를 구축하기 위해서는 해당 약물 자료들의 수집이 필요하다. 약물 자료 수집에서는 위에서 언급한 건강보험심사평가원[28], 약학정보원[29], 식품의약품안전처[30], 대한약사회[31]의 약물 기본 자료 수집하고 KAERS [11]와 MetaLAB [32,33]자료를 약물 부작용 분석 결과로서 수집하였다. 약물 기본 자료에서 건강보험심사평가원에서 제공하는 2분기 ATC파일에서 EDI코드(제약사코드[4]+품목코드[4]+포장단위[1])를 중심으로 약학정보원 자료와 매핑 후 건강보험심사평가원의 약물 부작용 정보를 추가적으로 활용해 49,553개의 약물 자료를 만든 후 방대한 양의 데이터를 편리하게 저장하고 효율적으로 관리할 수 있도록 Oracle 데이터베이스 관리 시스템(DataBase Management System, DBMS)을 통해 활용하였다. 약물 부작용 분석결과 자료(MetaLAB, KAERS)와 환자 정보, 데이터 베이스 내 환자가 보고한 자료가 약물 부작용에 대한 이상 반응 사례를 검토 할 수 있도록[22,23], PGHD 테이블 별로 만들어 정규화를 거쳐 PD2B 데이터베이스를 생성하였다.
연구 결과
데이터 가공
다양하게 수집된 약물 관련 데이터는 데이터베이스 테이블 및 컬럼명에 적합하게 분류되어지는 과정에서 데이터의 가독성 및 활용성을 높이기 위해 가공이 필요하다. 예를 들면, 성분명의 경우 “ Oseltamivir Phosphate 오셀타미비르인산염 39.4 mg (오셀타미비르(으)로서 30 mg)”로 입력되어 있는데 이를 영문 성분명, 한글 성분명, 성분 함량 이렇게 세 가지 부분으로 나누고 특수 문자로 제거하여, “ B_제품명: 넥스플루캡슐 30 mg”, “ B_성분명_영어: Oseltamivir Phosphate“, ” B_성분명_한국어: 오셀타미비르인산염”, “ B_성분_함량: 39.4 mg”, “ B_비고: 오셀타미비르(으)로서 30 mg”로 나누어 재구조화하였다. 이렇게 재구조화된 데이터를 활용하여 향후 앱 화면 구성에서 완전한 상태로 구현될 수 있도록 데이터의 구조를 파악하여 컬럼명과 데이터 입력 형태를 설정하였다.
데이터베이스 생성
앞서 데이터 가공을 통해 완성된 테이블들은 약물 기본정보(약물 기본 테이블, 약물 정보 테이블, 복약 정보 테이블, 효능 효과 테이블, 주의 테이블, 금기 테이블, 일반 사용 테이블) 총 7개이며 EDI코드를 중점으로 생성되었다. 약물 부작용 분석 결과는 KAERS [11], MetaLAB [32,33] 2개의 테이블과 환자 정보를 담고 있는 환자 정보 테이블 1개, 환자가 생성한 데이터를 활용 할 수 있도록 PGHD를 활용한 처방전이 담기는 OCR테이블, 자유 게시판 테이블, 약물 부작용 보고 테이블, 환자 자가 건강 테이블 4개를 만들어서 외래키를 기반으로 구축하였다.
마지막으로 원활한 약물 부작용 보고 테이블의 활용을 위해 환자 정보가 담긴 테이블과 약물 분석정보에서 약물 부작용 정보를 담고 있는 MeDDTA_PT_ID (KYUH [M])의 다중 컬럼 기본키를 활용하고자 환자_약물_보고라는 테이블을 만들어 여러 개의 부작용 정보를 담아도 무결성에 위배되지 않도록 구축하였다.
구축된 스키마 구성을 보면 오라클 DB에 약물 정보, 약물 부작용 분석 결과 외에 환자 정보, 커뮤니티, 헬스 다이어리 등 환자가 생성한 데이터 등이 생성된 것을 알 수 있다(Figure 2).
추가적으로, 각 테이블의 사용 목적, 비고 사항 등의 테이블에 대한 기록뿐만 아니라 테이블에 포함된 각 컬럼의 이름 데이터 타입 및 제약 조건을 기록을 담는 데이터 명세서도 작성하였다(Appendix 1).
테이블 구성
구축된 DB의 구성은 15개의 테이블로 구성되어 있고 약물, 부작용 관련 정보를 담고 있다. Table 2는 약물과 부작용 관련하여 약물 기본 정보 영역, 약물 분석 정보 영역에 있는 테이블들에서 주요 약물, 부작용 정보의 구성을 나타낸다.
데이터베이스 구축
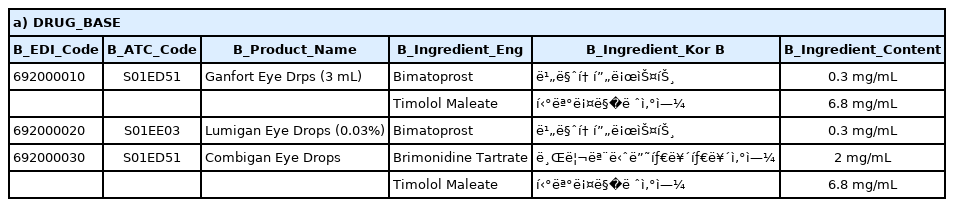
Table 2는 저장된 테이터가 Oracle 프로그램에서 제대로 작동되는지 살펴보기 위해 데이터 조작어(data manipulation language, DML) 중 하나인 SELECT로 검색한 결과이다.
(a) 기본 정보 테이블이며, EDI코드, ATC코드, 제품명, 성분(영어, 한국어, 함량) 등 약물 기본 정보를 포함하고 있다.
(b) MetaLAB 테이블이며, EDI코드, ATC코드 DRUG_ID, 부작용확률, 유의확률, 부작용 ID, 부작용(영어, 한국어)으로 실제 약물 데이터의 부작용 분석 정보를 포함하고 있다.
(c)) 환자 정보 테이블이며 환자 번호, 약물코드, 의심증상, 과거 병력, 기저 질환 등 환자의 데이터가 담겨있다.
(d)) 환자 생성 정보 테이블이며, 환자가 자신이 복용하는 약물에 대해 다이어리 형식으로 나타내며, 환자 번호 제품명 성분명(영어, 한국어), 복용일, 복용량, 복용 상태 등을 자신의 증상을 적는 테이블을 나타낸다.
PD2B 활용 방안
Figure 3은 구축한 데이터베이스 PD2B를 통해 환자가 약물 검색 시 환자에게 약물의 기본 정보로 제품명, 성분(영어, 한국어, 용량), 저장방법, 효능 효과 등을 제공하고 추가적으로, 환자 스스로가 데이터 기반 환자 실제 약물의 부작용 정보가 필요 시 MetaLAB [32,33]을 바탕 으로 이 약의 부작용 증상 및 복용 시 부작용 발생 확률과 KAERS [11]에서의 실제 환자의 경험을 바탕으로 약물 부작용 분석 결과를 모바일 앱을 통해 제공할 예정이다.
고찰 및 결론
의사의 적절한 처방, 약사의 정확한 조제, 환자의 올바른 복약 등에도 불구하고 예측하지 못한 약물 부작용이 발생한다[36]. 또한 종합 병원에 입원한 환자의 6%가 입원 중에 약물 부작용을 경험하며, 이들 부작용의 30-50%는 사전 예방이 가능한 것으로 밝혀졌다[37]. 본 연구는 이러한 약물 사용에 대한 부작용을 기존 의료진에 의한 보고만이 아닌[6,7], 환자가 주도적으로 보고를 하고자 하였다. 부작용 보고를 통해 다양한 약물 부작용 식별[5]과 환자의 약물에 대한 인식 및 부작용 경각심을 높여 조기 조치를 목적으로 PGHD를 활용한 환자 주도적 약물 부작용 탐색을 위한 DB 설계를 진행하였다.
DB 개발을 위해 의약품 안전성 정보에 있는 병용 금기, 연령 금기, 임부 금기, 효능군 중복 주의 등 의약품에 대한 안전 정보의 목적[36]을 확인한 후, 기본 약물 자료 수집(건강보험심사평가원[28], 약학정보원[29], 식품의약품안전처[30], 대한약사회[31]) 및 실제 환자의 약물 분석 결과 사례인 MetaLAB [32,33], KAERS [11] 자료를 활용하였다.
본 논문에서 제시하는 PGHD를 활용한 환자 주도적 약물 부작용 탐색을 위한 DB 구축은 약물 부작용에 대해 향후 다양한 도구(웹사이트, 모바일 앱, 웨어러블 기기 등)에 기본적인 틀로 활용 할 수 있을 것으로 예상한다. 우리의 연구는 환자에게 제공 되는 약물의 기본 정보 제공 외에 실제 환자들의 약물 부작용 분석 정보를 활용하여 올바른 약물 인지 및 부작용 보고 PGHD를 활용한 환자의 삶의 질 상승에 도움을 주고자 한다.
본 연구에서 만든 PD2B의 강점은 다양한 약물 관련 사이트(건강보험심사평가원, 약학정보원, 식품의약품안전처, 대한약사회)와 실제 환자의 약물 분석 결과를 활용하였다는 것이다. 약물의 기본정보(성분명, 제품명, 의약품안전성정보 등)와 실제 환자 약물 분석 결과가 담긴 MetaLAB, 자발적 약물 부작용 보고 정보 KAERS를 환자에게 제공함으로써 환자 본인 스스로 약물 부작용 여부를 인지한다. 또한, 환자 생성 테이블을 통해, 건강 다이어리, 환자 자유 게시판 등을 활용하여 환자가 스스로 PGHD를 생성할 수 있으며, 자발적 보고를 통해 유해 약물 이상 반응 카드 등의 적절한 조치를 받을 수 있을 것으로 기대된다.선진국에서는 실제 부작용의 5% 내외만이 약물 부작용으로 보고되는 것으로 알려져 있으며, 상당수의 자료가 불완전하여 약물의 원인-인과 관계 평가에 많은 어려움을 가지고 있다[38]. 그렇지만 우리가 만든 DB는 의학적 진단이 아닌 증상의 보고를 목적으로 두고 있어서 많은 환자들이 다양한 도구(웹사이트, 모바일 앱, 웨어러블 기기 등)를 통해 손쉽게 약물 부작용을 보고 한다면 예측하지 못한 약물 유해 반응을 찾을 수 있을 것으로 기대된다.
우리 연구의 한계점은 앱 개발 및 구현을 통해 실증 단계의 전 단계로써 구현 검증을 받아야 한다는 것과 약물 기본 정보 테이블의 경우 건강보험심사평가원의 2020년 2분기 ATC 약물의 EDI와 약학정보원의 EDI만의 매핑을 통해 한정적인 약물이라는 점과 약물 부작용 분석 결과 테이블의 경우 MetaLAB의 101가지 특정 약물에 한정되며 새로운 데이터에 대한 업데이트가 필요하다는 점이다.
본 연구에서 설계된 PD2B의 기대 효과는 다음과 같다.
• 자발적 부작용 보고를 통한 유해 약물 이상 반응 카드 등의 적절한 조치를 통한 환자들의 약물 부작용 안전 의식 향상
• 약물 기본 정보와 약물 분석 결과를 활용한 환자 자발적 약물 보고 시스템 구축
• 환자가 병원에 가지 않더라도 측정하고 저장 할 수 있는 PGHD를 활용해 의료진이 놓칠 수 있는 정보 파악 및 조기 치료 할 수 있는 자발적 약물 보고 데이터 생성
• 환자의 상태 파악을 토대로 의료진의 환자 부작용 보고 대응력 향상을 기대 할 수 있다.
본 연구에서 만들어진 PD2B를 기반으로 앱과의 연동을 통해, 환자의 약물 부작용 및 일반인의 약물 부작용 인식이 개선되며 약물 부작 용에 대한 안전 문제에도 개선에 도움을 줄 것으로 기대한다.
Acknowledgements
This research was supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (2021R1I1A3044287).
Notes
No potential conflict of interest relevant to this article was reported.