AbstractObjectivesThe purpose of this study is to provide availability of laboratory results in differential diagnosis of iron deficiency anemia (IDA) and anemia of chronic disease (ACD).
MethodsThis study was based on a systematic review of related to iron metabolism, IDA and ACD. We searched the published articles from 1992 to 2019 in Earticle, KISS, NDSL, RISS, DBpia and PubMed.
ResultsIDA accounts for more than 50% of all anemia patients, followed by ACD. Differential diagnosis is needed between IDA and ACD, which usually shows microcytic, hypochromic anemia. The standard for differential diagnosis is the bone marrow iron stain. However, bone marrow study is invasive, expensive so that it cannot be routinely performed. Consequently, the measurement of serum ferritin is the first level test for differential diagnosis. Serum ferritin level is good indicators of storage iron; decreased levels in IDA and normal to increased levels in ACD. However, serum ferritin level may increase irrespective of iron stores in cases of chronic disease. Therefore, it is difficult to diagnose IDA coexisting with ACD. Another available biomarker is soluble transferrin receptor (sTfR). The sTfR level is not affected by chronic disease; it is elevated in IDA but not in ACD. Additionally, the sTfR/log ferritin index is suggested as a good biomarker for identifying coexisting IDA and CAD.
서 론빈혈은 혈색소(Hemoglobin, Hb), 적혈구용적률(Hematocrit, Hct) 그리고 적혈구 수가 감소된 상태로 정의할 수 있으며 진단명이 아닌 기저질환에 의해 나타나는 일종의 증상이라 할 수 있다. 인종, 성별, 연령에 따라 참고치의 차이가 있으나 세계보건기구(World Health Organization, WHO)에서는 빈혈을 성인 남성에서 Hb <13 g/dL, 여성에서 Hb <12 g/dL로 규정하고 있다. 국민건강영양조사(Korea National Health and Nutrition Examination Survey, KNHANES)를 분석한 자료에 의하면 빈혈의 유병률은 10세 이상에서 8.2%로 나타났으며 60세 이상의 노인 인구에서는 13.3%로 나타났다[1,2]. 특히, 철결핍빈혈은 전체 빈혈의 50%정도를 차지하는 가장 흔한 빈혈이며 그 다음으로 노인환자와 입원환자에서 발생률이 높은 만성질환빈혈이 진단검사의학과에서 자주 접하게 되는 빈혈이다[3,4].
철결핍성빈혈은 철결핍에 기인한 것으로 흡수장애, 만성실혈 그리고 철 요구도의 증가가 원인인 반면, 만성질환빈혈은 면역체계의 활성화로 인한 철대사 장애뿐만 아니라 적혈구 수명의 단축, 적혈구 생성인자에 대한 반응성의 감소 등 다양한 원인에 의해 발생한다[5-7]. 철결핍 빈혈과 만성질환빈혈의 진단은 형태학적 분류, 원인적 분류에 따라 구분할 수 있는데, 현재 진단검사의학과에서는 일반적으로 자동혈구분석기를 이용한 적혈구 수, Hb, Hct, 평균적혈구용적(mean corpuscular volume, MCV), 평균적혈구혈색소(mean corpuscular hemoglobin, MCH), 평균적혈구혈색소농도(mean corpuscular hemoglobin concentration, MCHC), 적혈구분포폭(red cell distribution width, RDW)을 이용하여 형태학적 분류가 가능하고, 그물적혈구 수, 그물적혈구 지수(reticulocyte production index, RPI), 혈청철(serum iron), 총철결합능(total iron binding capacity, TIBC), 혈청 페리틴(serum ferritin) 검사, 트랜스페린(transferrin), 트랜스페린포화도(transferrin saturation)를 통해 원인적 분류를 하고 있다[8]. 형태학적으로 MCV가 80 fL이하 이면서 MCHC가 31% 이하인 경우를 소적혈구, 저색소적혈구빈혈로 분류하고 있으며 이 분류에 속하는 빈혈에는 철결핍빈혈, 만성질환빈혈, 철적 혈모구빈혈, 납중독과 지중해성빈혈이 포함되어 있어 감별이 필요하다[9]. 특히, 철결핍빈혈과 만성질환빈혈은 임상에서 흔하게 접하는 빈혈로 검사상 낮은 혈청철이 공통적인 특징인 반면, 각각의 병리기전 및 치료방법이 다르므로 감별이 필요하다. 또한, 두 빈혈이 함께 공존하는 경우에는 감별진단을 하는 것이 어렵다[4,10]. 이 두 질환의 가장 좋은 감별 방법은 체내 저장철의 상태를 평가하는 것이다. 체내 저장철의 평가는 골수 천자나 골수생검을 실시하여 얻은 검체로 철염색을 실시하는 것이 표준검사(gold standard)이지만 침습적이고 고가여서 환자에게 부담을 주므로 잘 이용되지 않는다. 대신 적혈구 지수(RBC indices), 혈청철, 총철결합능, 혈청 페리틴, 트랜스페린, 트렌스페린 포화도 등으로 저장철의 상태를 평가한다. 혈청 페리틴은 체내 저장철 상태를 잘 반영하는 지표이지만 고령이거나 감염 및 염증반응에 의해 생성되는 급성반응기물질(acute phase reactant)에 의해 증가하고 간질환 그리고 악성 종양이 있는 경우에도 증가하므로 혈청 페리틴만으로 철결핍 상태를 파악하기에는 무리가 있다. 또한, 트랜스페린 포화도 사용되고 있으나 트랜스페린이 만성염증상태에서 감소하고 혈중 철의 일내변동이 심하여 진단에 제한적이다[3]. 만성질환빈혈이 경증이나 중등도인 경우에는 정상적혈구, 정상색소빈혈의 형태로 나타나지만 병이 더 진행 될 경우 소적혈구, 저색소적혈구빈혈을 나타내므로 철결빕성빈혈과 형태학적인 구분이 어려워진다[11]. 더욱이, 만성염증이나 악성종양에 의해 발생한 만성질환빈혈 환자에게 철분요법을 실시할 경우 종양세포나 미생물의 증식을 촉진하는 결과를 초래할 수 있고, 과잉의 철분은 면역세포에 침착하여 면역기능을 저하시켜 종양이나 감염상태를 더욱 악화할 수 있다[12].
따라서, 소적혈구, 저색소적혈구빈혈에서 철결핍빈혈과 만성질환빈혈을 초기에 감별하는 것이 치료와 임상경과에 중요하다. 본 종설에서는 철 대사의 이해를 바탕으로 철결핍빈혈과 만성질환빈혈의 발생기전을 이해하고 두 빈혈을 감별할 수 있는 검사지표에 대해 논하도록 하겠다.
본 론철 대사철은 산소 운반과 에너지 생성에 중요한 금속이며 혈색소, 미오글로빈, 시토크롬과 같은 헴 복합체를 형성한다. 이러한 철의 부족은 철결 핍빈혈과 같은 질병을 유발하고, 과잉은 철침착증(siderosis)과 활성산소를 생산하여 조직손상을 초래한다[13]. 따라서, 적정한 농도의 철을 유지하기 위해 여러가지 복잡한 기전을 통해 철의 항상성이 유지되고 있다. 정상인의 경우 체내에 약 3-5 g의 철을 가지고 있으며, 약 65%는 적혈구의 혈색소에, 약 25%는 대식세포 및 간세포에 저장철의 형태인 페리틴(ferritin), 헤모시데린(hemosiderin)의 형태로, 나머지 약 10%는 근육, 혈장, 세포의 시토크롬 등에 존재하는 것으로 알려져 있다. 또한, 일부 페리틴은 혈청 페리틴의 형태로 혈액 중으로 분비되며 저장철의 중요한 지표가 된다[14,15]. 정상인의 경우 하루 2천 억개 이상의 적혈구를 생산하기 위해 20-20 mg의 철이 필요하며 대부분 수명을 다한 적혈구의 Hb에서 철을 재활용한다. 그리고, 땀, 생리, 소장상피세포의 탈락에 의해 하루 1-2 mg이 소실되는데 이를 보충하기 위해 샘창자(duodenum)을 통해 소실된 양만큼을 흡수한다. 다른 미네랄과 달리 배설기전이 존재하지 않아 흡수의 조절을 통해 항상성을 유지한다. 전신의 철의 항상성 유지는 철을 세포막을 통해 배출하는 단백질인 페로포틴(ferroportin, FPN)과 이를 조절하는 단백질인 헵시딘(hepcidin)에 의해 조절된다[13,15-17].
흡수와 수송음식물을 통해 흡수되는 철은 헴철(heme iron)과 비헴철(non-heme iron)로 나뉘며 서로 다른 기전을 통해 흡수된다[18]. 헴철은 동물성 식품에 많이 포함되어 있으며 흡수기전은 아직까지 명확하지 않다. 단지, 헴철이 세포내섭취(endocytosis)에 의해 장상피세포에 의해 흡수되면 헴산화효소(heme oxygenase 1, HO1)에 의해 산화되고, 포르피린으로 부터 떨어져 나와 비헴철과 같은 기전으로 흡수될 것이라고 추측하고 있다[19,20]. 반면, 비헴철은 동물성 식품 및 식물성 식품에도 많이 포함되어 있으며 대부분 3가철(ferric, Fe3+)형태로 존재한다. 식품에 포함 된 3가철은 장세포에 존재하는 철환원효소(ferric reductase)에 의해 2가철로 환원되고, 2가금속이온전달체(divalent metal iron transporter, DMT1)에 의해 장세포의 세포질로 흡수된다. 이때, 위산과 비타민 C가 3가철의 흡수를 촉진한다[21-23]. 흡수된 2가철은 장세포에 페리틴의 형태로 저장되거나 장세포의 기저측면(basolateral membrane)의 페로포틴을 통하여 혈장 내로 전달된다. 전달된 2가철은 철산화효소인 헤파에스틴(hepaestin)에 의해 3가철로 다시 산화된다[24]. 산화된 3가철은 두 개의 3가철 결합부위를 가진 아포트랜스페린(apo-transferrin)과 결합한 후 트랜스페린(transferrin, Tf)형태로 철이 필요한 조직으로 운반된다[25]. 체내 철결핍 상태에서 철의 흡수를 촉진하기 위해 혈청 트랜스페린의 농도는 상승하고, 따라서 철이 결합할 수 있는 총사이트 수인 총철결합능(total iron binding capacity, TIBC)은 상승한다. 하지만 흡수된 철이 부족한 경우 철로 포화된 트랜스페린 포화도(혈청철/TIBC×100%)는 감소한다[26].
혈청 중 철-트랜스페린 복합체는 세포표면의 존재하는 트랜스페린 수용체(transeferrin receptor, TfR)와 결합하고 세포내섭취를 통해 세포 내부로 이송된다. 엔도좀 내부에서 3가철이 2가철로 환원되어 세포질로 방출되고 적혈구에서는 Hb를 만드는데 사용된다[25,27]. 또한, 체내 철분의 부족을 대비하여 간세포에 페리틴의 형태로 저장한다. 그리고, 비장의 대식세포는 수명을 다한 적혈구를 처리한 후 역시 페리틴의 형태로 철을 저장하고 있다가 필요 시 페로포틴을 통하여 혈장의 방출한다[17]. 세포 내부의 철 부족 시 트랜스페린 수용체의 생산이 증가하게 되며, 이중 일부는 절단되어 가용성 트랜스페린(soluble transferrin receptor, sTfR)의 형태로 혈액 내로 방출되게 된다. 세포의 철분 요구도가 증가하면 트랜스페린 수용체가 증가하게 되고 따라서, 혈청 중에 가용성 트랜스페린도 상승하게 되므로 가용성 트랜스페린는 세포 내부의 철분 양과 역상관 관계를 갖는다[5,28].
철의 항상성 조절전신 철의 항상성 조절은 간에서 생성되는 헵시딘에 의해 조절된다. 헵시딘은 처음에 항미생물 작용을 하는 단백질로 알려졌으나, 이후 철의 항상성을 조절하는 핵심 단백질로 증명되었다[29-31]. 헵시딘은 철을 세포막을 통하여 외부로 배출하는 유일한 단백질인 페로포틴의 세포막 발현을 조절함으로써 철의 항성성을 조절한다. 헵시딘은 페로포틴과 결합하고 용해소체(lysosome)을 형성하여 분해한다. 따라서, 철분이 세포 밖으로 유출되는 것을 막는다[31]. 페로포틴은 철을 흡수하는 샘창자의 장세포, 철을 저장하는 간세포, 그리고 철을 재활용하는 대식세포에서 높게 발현된다[17,23,32]. 따라서, 헵시딘은 세포표면의 페로포틴의 양을 감소시켜 장에서 철의 흡수를 제한하고 저장철의 이용 및 철의 재활용을 제한함으로써 혈청철을 낮춘다.
간에서 헵시딘의 생산은 체내 철의 저장상태와 염증에 의해 조절된다. 체내 철분이 감소하면 간세포에서 헵시딘 생산이 감소되고 장세포에서 페로포틴을 통하여 철분을 혈액으로 흡수하고 대식세포와 간세포의 철분도 혈액으로 방출한다. 반면, 체내 철분 수치가 높을 때는 헵시딘의 생성이 증가하여 장에서의 흡수와 대식세포 및 간세포에서의 철분의 방출을 억제한다[33]. 헵시딘은 급성반응단백질(acute phase protein)이다[34,35]. 만성 감염, 염증, 악성종양 등의 만성질환에서 생성된 IL-6는 간세포에 작용하여 헵시딘의 생성을 증가시킨다[36]. 이러한 증가는 체내 저장철의 상태와 무관하게 증가된다. 따라서, 만성질환 상태에서 철의 흡수와 체내 저장철의 이용이 감소하게 된다. 이와 같은 염증상황에서의 철분의 흡수 및 이용의 제한은 세균에 대한 비특이적인 면역반응으로 생각된다(Figure 1) [36].
철결핍빈혈철결핍빈혈의 원인철결핍빈혈은 철의 섭취부족, 흡수장애, 소실증가 그리고 생리적 요구도의 증가에 의해 발생한다[37,38]. 1일 평균 소실되는 철의 양은 땀, 생리, 소장상피세포의 탈락에 의해 하루 1-2 mg정도이므로 정상적인 식사를 하는 경우에는 철결핍이 발생하기 어렵다. 하지만, 채식주의자, 무리한 다이어트를 실시하는 경우 철분의 공급이 소실량 보다 감소하여 철결핍이 발생한다. 급속히 성장하는 영·유아, 청소년 그리고 철의 요구량이 증가하는 임신, 수유기에는 필요한 철의 양이 증가하여 추가적인 철분의 섭취가 있어야 철결핍을 막을 수 있다[39]. 식품을 통해 충분한 철분을 섭취하더라도 철분을 흡수할 수 없는 경우에도 철결핍 상황이 초래된다. 철을 흡수하기 위해서는 위산이 필요하고 철분은 주로 샘창자에서 흡수되므로 위, 십이지장에 질환이 있거나 수술을 통해 위나 십이지장을 절제한 경우에 철결핍이 발생할 수 있다[40]. 특히, Helicobacter pyroli 감염은 위장관 출혈, 위산의 변화, 세균의 직접적인 사용을 통해 철의 소실이나 흡수장애를 유발한다. 또한, 제산제의 지속적인 사용은 위산의 분비를 억제하여 철의 흡수를 방해한다. 철의 소실증가로 인한 철결핍성빈혈의 주된 원인은 가임기 여성의 과도한 월경이 주된 원인이며 남성의 경우 위장관계의 악성종양, 위십이지장 궤양 등으로 인한 위장관출혈이 주요 원인이다(Table 1) [41].
철결핍빈혈의 검사실 진단철결핍으로 인한 철결핍빈혈은 몇 가지 단계를 거쳐 천천히 진행하게 된다. 우선 간, 비장 등에 존재하는 저장철이 감소하고, 다음으로 혈청철과 기능철인 혈색소 내의 철이 순차적으로 감소하게 되어 철결핍빈혈이 나타나게 된다. 저장철이 감소하는 단계에서는 철이 부족하지만 혈색소를 정상적으로 합성할 수 있기 때문에 빈혈을 인식하기가 어렵다. 저장철이 감소하기 시작하면 그물적혈구혈색소량(reticulocyte hemoglobin content, CHr) 함량이 감소하기 시작하지만 많은 순환 적혈구들로 인해 혈색소 수치는 정상을 유지한다[3]. 저장철이 완전 고갈되면 저장철의 지표인 혈청 페리틴이 12 ng/mL 이하로 감소한다[38]. 저장철이 고갈되면 혈청철에 존재하는 철을 이용하여 혈색소를 합성한다. 이시기에는 혈청철은 감소하는 반면 장에서 철의 흡수를 증가시키기 위해 트랜스페린의 생산량을 늘리게 되어 총철결합능(TIBC)은 상승하고 혈청철의 감소와 총철결합능의 증가로 인하여 트랜스페린 포화도(혈청철/TIBC×100%)는 감소한다. 트랜스페린 포화도가 16% 미만으로 감소하면 혈색소 합성이 저하되어 철결핍성빈혈 상태가 되고 저색소성, 소적혈구성, 적혈구부동증(anisocytosis)과 같은 형태학적 특징이 나타난다. 적혈구부동증을 나타내는 적혈구분포폭(red cell distribution width, RDW)은 잠재적 철결핍성빈혈에서 흔하게 관찰되므로 진단에 도움이 된다[42]. 그리고, 철이 부족한 세포는 가능한 많은 철을 세포 내부로 흡수하기 위해 트랜스페린 수용체의 발현을 늘리고, 그 결과 가용성 트랜스페린 수용체가 혈청검사에서 상승하게 된다. 또한, 철 결핍으로 헴 합성에 장애가 발생하게 되고 철과 결합하지 못한 유리적혈구포르피린(free erythrocyte protoporphyrin, FEP)이 증가한다. 유리적혈구포르피린은 아연과 결합하여 아연 프로토프르피린(zinc protophorphyrin, ZPP)을 형성한다. 철이 결핍되면 아연과의 결합이 증가하여 상승된 수치를 나타낸다[43] (Table 2).
만성질환빈혈만성질환빈혈의 원인만성질환빈혈은 철결핍빈혈 다음으로 흔한 빈혈이며 고령환자와 입원환자에서 자주 접하게 된다[11]. 만성질환빈혈은 노인 인구가 증가함에 따라 함께 증가할 것으로 생각된다. 염증성질환, 감염, 악성종양이 만성질환의 약 75%를 차지하는 주된 원인이다[44]. 만성질환빈혈은 세포 대사과정에 필수적인 철의 사용을 제한하여 감염 및 종양세포의 증식을 억제하는 면역반응의 활성으로 발생한다[6]. 이러한, 면역반응의 활성화로 생산되는 다양한 시토카인은 철 대사 장애뿐만 아니라 적혈구 수명 단축, 적혈구 생성 장애, 철의 재사용 억제 등을 통하여 빈혈을 유발한다[11]. 대표적 염증성 시토카인인 IL-6는 간세포의 IL-6 수용체와 결합 후 signal transducer and activator of transcription 3 (STAT-3)를 활성화하여 헵시딘의 생산을 증가시킨다. 헵시딘은 철을 세포 밖으로 배출하는 유일한 단백질인 페로포틴의 작용을 억제하여 장세포에서 음식물을 통한 철흡수를 방해하고 간세포와 대식세포에서 철의 동원을 제한한다. 그 결과 염증성질환, 감염 그리고 악성종양에서 혈청 페리틴의 수치가 증가하게 된다. 음식을 통해 정상적으로 철을 섭취하고, 체내에도 충분한 철이 있음에도 불구하고 염증상황에서 철의 이용이 제한되어 빈혈이 발생하게 된다[20,45].
만성질환빈혈의 검사실 진단만성질환빈혈은 대부분 경증이거나 중등도 빈혈을 나타내고 정상 적혈구, 정상색소적혈구 형태로 소적혈구, 저색소적혈구빈혈을 나타내는 철결핍빈혈과 구분되지만 병이 좀 더 진행하는 경우 소적혈구, 저색소적혈구빈혈을 나타내므로 철결핍빈혈과 감별이 필요하다[11]. 만성 염증성빈혈은 염증반응에 의해 생성된 헵시딘에 의한 철의 이용제한이 주된 원인이다. 만성염증빈혈에서 철의 이용제한에 의해 낮은 혈청철 농도를 보이고 간세포에서 생산되는 트랜스페린은 저장철의 상태를 반영하므로 정상이거나 감소된 소견을 보이다. 따라서, 트랜스페린의 간접측정 지표인 총철결합능(TIBC)는 정상이거나 감소하게 된다. 트랜스페린 포화도는 트랜스페린의 양에 따라 정상이거나 감소할 수 있다. 저장철의 지표로 활용되는 혈청 페리틴은 급성반응기단백로 염증상황에서 증가할 뿐만 아니라 헵시딘의 작용으로 저장철이 세포외부로 방출되지 못하기 때문에 다소 증가하거나 정상을 보인다[46]. 앞서 언급한 것처럼, 만성질환빈혈은 저장철이 감소하지 않으므로 혈청 트랜스페린 수용체는 증가하지 않고 염증상황의 영향도 받지 않는다. 따라서, 트랜스페린 수용체 수치의 확인은 철결핍빈혈과 만성질환빈혈의 감별에 도움이된다[43]. 아연 프로토프르피린(zinc protophorphyrin, ZPP)은 적혈구생성에 동원되는 철이 부족하기 때문에 증가하지만 철결핍빈혈에서도 증가하므로 두 빈혈의 감별에는 도움이 되지 못 한다. 헵시딘은 철대사에 중요한 역할을 수행하고 염증상황에서 증가하므로 헵시딘 수치를 이용하여 만성질환빈혈과 철결핍성빈혈을 감별하고자 하는 연구가 활발히 진행되고 있다(Table 2) [13].
철결핍빈혈을 동반한 만성질환빈혈철결핍빈혈은 소구성, 저색소성빈혈의 형태학적 소견을 나타내고 만성질환빈혈의 경우 빈혈 증상이 경미하고 대부분 정구성, 정색소성빈혈을 나타내지만 중증인 경우에는 소구성, 저색소성빈혈을 나타내므로 형태학 소견으로 구분이 어렵다. 또한, 철결핍빈혈에서 특징적으로 증가하는 RDW가 증가한 경우 두 빈혈의 감별에 도움이 되지만 그렇지 않은 경우에는 추가적인 감별진단이 필요하다[47]. 철결핍빈혈과 만성질환빈혈을 감별하는 가장 신뢰할 만한 혈청학적 검사는 혈청 페리틴이다. 혈청 페리틴이 12 ng/mL 이하로 감소한 경우 철결핍빈혈로 진단하는데 큰 무리가 없고 TIBC가 증가한 경우에도 감별에 도움이 된다. 하지만, 감염, 염증, 만성질환 및 악성종양이 있는 경우 철결핍빈혈을 진단하지 못할 수 있다[11]. 철결핍빈혈을 동반한 만성질환빈혈의 경우, 철결핍이 있더라도 급성반응기단백질의 영향으로 혈청 페리틴이 상승하고 TIBC도 정상일 수 있다. 특히, 혈청 페리틴이 30-100 ng/mL인 경우 추가 적인 검사를 통하여 철결핍빈혈의 동반을 확인하여야 한다. 가장 좋은 검사법은 골수 검체를 이용한 철염색을 통하여 저장철의 상태를 파악해야 하지만 침습적인 검사여서 일반적으로 추천되지 않는다. 혈청 트랜스페린 수용체는 혈청 페리틴과 달리 급성반응성물질에 영향으로 증가하지 않고 저장철의 상태를 잘 반영하므로 만성질환빈혈에서 철결핍성빈혈을 동반할 경우 민감한 지표라고 생각되고 있다[5,48]. 만성염증빈혈에서는 혈청 트랜스페린 수용체가 정상을 나타내지만 철결핍빈혈을 동반하는 경우 증가된 수치를 나타낸다. 또한, 혈청 트랜스페린 수용체와 저장철의 지표인 혈청 페리틴을 이용하여 혈청 트랜스페린 수용체/로그 페리틴(sTfR/log ferritin) 수치는 철결핍빈혈에서 상승된 비율(>2)을 나타내며 만성질환빈혈에서는 정상 비율(<1)을 나타낸다. 그리고 철결핍빈혈을 동반한 만성질환빈혈에서는 상승된 비율(>2)을 나타내므로 만성질환빈혈에서 저장철의 고갈을 민감하게 파악할 수 있다(Table 2) [11].
결 론철결핍빈혈과 만성질환빈혈은 빈혈 중 가장 빈도가 높다. 철결핍빈혈은 소적혈구, 저색소적혈구빈혈의 형태를 나타내고, 만성질환빈혈은 일반적으로 정상적혈구, 정상색소빈혈을 나타내지만 병기에 따라서 소적혈구, 저색소적혈구빈혈 나타내므로 추가적인 감별진단이 필요하다. 두 질환의 감별진단은 철결핍빈혈에서는 저장철의 고갈, 만성질환빈혈에서는 저장철의 이용제한의 확인을 통하여 가능하다. 감별진단의 표준 검사는 골수 검체를 철 염색한 후 저장철의 상태를 파악하는 것이지만 침습적이어서 자주 이용되지 않는다. 그 대신 비침습적인 검사방법을 이용하여 저장철의 상태를 파악하고 있으며, 따라서 철 대사의 이해를 통한 검사결과의 해석은 두 질환의 감별진단에 필수적이다. 저장철의 상태를 파악하기 위한 일반적인 검사에는 혈청철, 총철결합능, 혈청 페리틴, 트랜스페린, 트렌스페린 포화도 등이 있다. 혈청 페리틴 검사는 저장철의 상태를 파악하기에 가장 신뢰할 만한 지표로 두 질환의 감별진단에 활용되어왔다. 철겹핍빈혈에서 다양한 원인에 의한 철의 흡수부족으로 인하여 저장철이 감소하므로 혈청 페리틴도 감소한다. 반면, 만성질환빈혈에서는 헵시딘과 염증성 시토카인의 영향으로 정상이거나 증가된 수치를 나타낸다. 또한, 철의 이용을 제한하는 단백질인 헵시딘은 만성질환빈혈에서 증가하므로 두 빈혈의 감별에 유용한 지표이다. 그러나, 철결핍을 동반한 만성질환빈혈에서는 철결핍이 있더라도 헵신딘과 염증성 시토카인의 영향으로 혈청 페리틴이 정상이거나 증가된 수치를 나타내므로 철결핍 상황을 감지하지 못할 수 있다. 따라서 최근에는 염증반응기물질의 영향을 받지 않고 세포 내 철의 상태를 잘 반영하는 혈청 트랜스페린 수용체와 저장철의 지표인 혈청 페리틴을 이용하여 혈청 트랜스페린 수용체/로그 페리틴(sTfR/log ferritin)수치가 철결핍을 동반한 만성질환빈혈을 조기에 감별하는데 사용되고 있다.
철결핍빈혈, 만성질환빈혈 그리고 철결핍빈혈을 동반한 만성질환빈혈은 철 대사의 이상으로 발생하는 것으로 형태학적으로 유사하여 추가적인 감별검사가 요구된다. 따라서 철 대사의 이해를 바탕으로 다양한 검사항목의 상호관계를 이해하는 것은 철결핍빈혈과 만성질환빈혈의 정확한 진단과 치료에 도움을 줄 것으로 사료된다.
ACKNOWLEDGEMENTSThis work was supported by the research grant of Cheongju University (2018.03.01-2020.02.29).
Figure 1.Systemic Iron Metabolism. Dietary iron is absorbed by duodenal enterocytes. In the plasma, iron circulates bound to transferrin to the organs which utilize iron. The principal consumer of iron is the erythroid bone barrow, and most of that iron comes from senescent erythrocytes by recycling in macrophages. Liver is the major storage organ of iron. Iron in the liver is stored ferritin and can be exported via ferroportin (FPN) when required by the body. Hepcidin regulates systemic iron homeostasis by regulating the stability of FPN. Synthesis of hepcidin is affected by iron levels as well as inflammation. 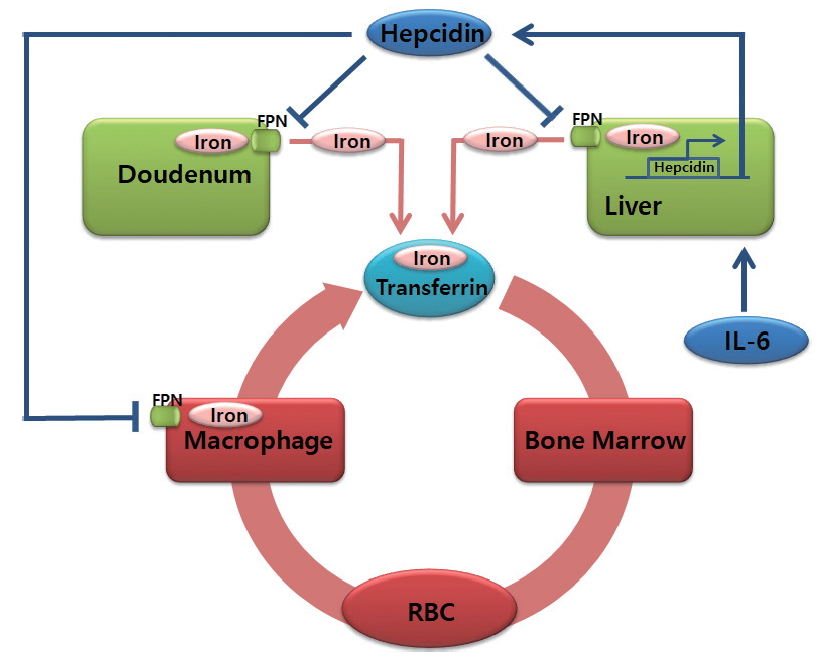
Table 1.Causes of iron deficiency Table 2.Laboratory tests for the differentiation of ACD and IDA
IDA, iron deficiency anemia; ACD, anemia of chronic disease; F, female; M, male; TIBC, total binding iron capacity; TfR, transferrin recetor; MCV, mean coruscular volume. Adapted from Camaschella [38]. REFERENCES1. Kim YJ, Han KD, Cho KH, Kim YH, Park YG. Anemia and health-related quality of life in South Korea: data from the Korean national health and nutrition examination survey 2008–2016. BMC Public Health 2019;19(1):735. Doi: 10.1186/s12889-019-6930-y
2. Shin HJ. Clinical characteristics of hematologic diseases in the elderly. Korean J Med 2013;85(1):33-37. (Korean). Doi: 10.3904/kjm.2013.85.1.33
3. Park SH, Seo YH, Park PH, Kim KH, Song YH, Jung JH, et al. Reticulocyte Indices for the differential diagnosis of anemia of chronic disease and iron deficiency anemia in adult women with microcytic hypochromic anemia. Lab Med Online 2011;1(3):147-152. (Korean).
4. Cavill I, Auerbach M, Bailie GR, Barrett-Lee P, Beguin Y, Kaltwasser P, et al. Iron and the anaemia of chronic disease: a review and strategic recommendations. Curr Med Res Opin 2006;22(4):731-737. Doi: 10.1185/030079906X100096
5. Yang SE, Park CJ, Min WK, Chi HS. Diagnostic availability of the soluble transferrin receptor in iron deficiency anemia and anemia of chronic disease. Korean J Clin Pathol 2000;20(2):119-125. (Korean).
6. Madu AJ, Ughasoro MD. Anaemia of chronic disease: an in-depth review. Med Princ Pract 2017;26(1):1-9. Doi: 10.1159/000452104
7. Fraenkel PG. Understanding anemia of chronic disease. Hematology Am Soc Hematol Educ Program 2015;2015:14-8. Doi: 10.1182/asheducation-2015.1.14
8. Markovic M, Majkic-Singh N, Ignjatovic S, Singh S. Reticulocyte haemoglobin content vs. soluble transferrin receptor and ferritin index in iron deficiency anaemia accompanied with inflammation. Int J Lab Hematol 2007;29(5):341-346. Doi: 10.1111/j.1365-2257.2006.00875.x
9. Keohane EM, Otto CN, Walenga JM. Rodak’s hematology e-book: clinical principles and applications. 6th ed. Philadelphia: Saunders; 2019.
10. Kim SY. Iron deficiency anemia: diagnosis and treatment. Korean J Med 2017;92(2):155-161. (Korean). Doi: 10.3904/kjm.2017.92.2.155
11. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005;352(10):1011-1023. Doi: 10.1056/NEJMra041809
12. Weiss G. Pathogenesis and treatment of anaemia of chronic disease. Blood Rev 2002;16(2):87-96. Doi: 10.1054/blre.2002.0193
13. Suh JK, Jeon I. Basic understanding of iron metabolism. Clin Pediatr Hematol Oncol 2018;25(1):1-9. (Korean). Doi: 10.15264/cpho.2018.25.1.1
14. Sharma N, Butterworth J, Cooper BT, Tselepis C, Iqbal TH. The emerging role of the liver in iron metabolism. Am J Gastroenterol 2005;100(1):201-206. Doi: 10.1111/j.1572-0241.2005.40152.x
15. Waldvogel-Abramowski S, Waeber G, Gassner C, Buser A, Frey BM, Favrat B, et al. Physiology of iron metabolism. Transfus Med Hemother 2014;41(3):213-221. Doi: 10.1159/000362888
16. Fuqua BK, Vulpe CD, Anderson GJ. Intestinal iron absorption. J Trace Elem Med Biol 2012;26(2-3):115-119. Doi: 10.1016/j.jtemb.2012.03.015
17. Donovan A, Lima CA, Pinkus JL, Pinkus GS, Zon LI, Robine S, et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metab 2005;1(3):191-200. Doi: 10.1016/j.cmet.2005.01.003
18. Ganz T. Systemic iron homeostasis. Physiol Rev 2013;93(4):1721-1741. Doi: 10.1152/physrev.00008.2013
19. Ferris CD, Jaffrey SR, Sawa A, Takahashi M, Brady SD, Barrow RK, et al. Haem oxygenase-1 prevents cell death by regulating cellular iron. Nat Cell Biol 1999;1(3):152-157. Doi: 10.1038/11072
20. Chifman J, Laubenbacher R, Torti SV. A systems biology approach to iron metabolism. Adv Exp Med Biol 2014;844:201-225. Doi: 10.1007/978-1-4939-2095-2_10
21. McKie AT, Barrow D, Latunde-Dada GO, Rolfs A, Sager G, Mudaly E, et al. An iron-regulated ferric reductase associated with the absorption of dietary iron. Science 2001;291(5509):1755-1759. Doi: 10.1126/science.1057206
22. Lane DJ, Richardson DR. The active role of vitamin C in mammalian iron metabolism: much more than just enhanced iron absorption. Free Radic Biol Med 2014;75:69-83. Doi: 10.1016/j.freeradbiomed.2014.07.007
23. Abboud S, Haile DJ. A novel mammalian iron-regulated protein involved in intracellular iron metabolism. J Biol Chem 2000;275(26):19906-19912. Doi: 10.1074/jbc.M000713200
24. Vulpe CD, Kuo YM, Murphy TL, Cowley L, Askwith C, Libina N, et al. Hephaestin, a ceruloplasmin homologue implicated in intestinal iron transport, is defective in the sla mouse. Nat Genet 1999;21(2):195-199. Doi: 10.1038/5979
25. Frazer DM, Anderson GJ. The regulation of iron transport. BioFactors 2014;40(2):206-214. Doi: 10.1002/biof.1148
26. Miller JL. Iron deficiency anemia: a common and curable disease. Cold Spring Harb Perspect Med 2013;3(7):pii: a011866. Doi: 10.1101/cshperspect.a011866
27. Ohgami RS, Campagna DR, Greer EL, Antiochos B, McDonald A, Chen J, et al. Identification of a ferrireductase required for efficient transferrin-dependent iron uptake in erythroid cells. Nat Genet 2005;37(11):1264-1269. Doi: 10.1038/ng1658
28. Beguin Y. Soluble transferrin receptor for the evaluation of erythropoiesis and iron status. Clin Chim Acta 2003;329(1-2):9-22. Doi: 10.1016/s0009-8981(03)00005-6
29. Park CH, Valore EV, Waring AJ, Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001;276(11):7806-7810. Doi: 10.1074/jbc.M008922200
30. Krause A, Neitz S, Magert HJ, Schulz A, Forssmann WG, Schulz-Knappe P, et al. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity. FEBS Lett 2000;480(2-3):147-150. Doi: 10.1016/s0014-5793(00)01920-7
31. Nicolas G, Bennoun M, Devaux I, Beaumont C, Grandchamp B, Kahn A, et al. Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice. Proc Natl Acad Sci U S A 2001;98(15):8780-8785. Doi: 10.1073/pnas.151179498
32. McKie AT, Marciani P, Rolfs A, Brennan K, Wehr K, Barrow D, et al. A novel duodenal iron-regulated transporter, IREG1, implicated in the basolateral transfer of iron to the circulation. Molecular cell 2000;5(2):299-309. Doi: 10.1016/s1097-2765(00)80425-6
33. Ganz T, Nemeth E. Hepcidin and disorders of iron metabolism. Ann Rev Med 2011;62:347-360. Doi: 10.1146/annurev-med-050109-142444
34. Malyszko J, Malyszko JS, Pawlak K, Mysliwiec M. Hepcidin, an acutephase protein and a marker of inflammation in kidney transplant recipients with and without coronary artery disease. Transplant Proc 2006;38(9):2895-2898. Doi: 10.1016/j.transproceed.2006.08.137
35. Nicolas G, Chauvet C, Viatte L, Danan JL, Bigard X, Devaux I, et al. The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation. J Clin Iinvest 2002;110(7):1037-1044. Doi: 10.1172/jci15686
36. Gardenghi S, Renaud TM, Meloni A, Casu C, Crielaard BJ, Bystrom LM, et al. Distinct roles for hepcidin and interleukin-6 in the recovery from anemia in mice injected with heat-killed Brucella abortus. Blood 2014;123(8):1137-1145. Doi: 10.1182/blood-2013-08-521625
37. Short MW, Domagalski JE. Iron deficiency anemia: evaluation and management. Am Fam Physician 2013;87(2):98-104.
38. Camaschella C. Iron deficiency: new insights into diagnosis and treatment. Hematology Am Soc Hematol Educ Program 2015;2015:8-13. Doi: 10.1182/asheducation-2015.1.8
39. Baird-Gunning J, Bromley J. Correcting iron deficiency. Aust Prescr 2016;39(6):193-199. Doi: 10.18773/austprescr.2016.069
40. Khanbhai M, Dubb S, Patel K, Ahmed A, Richards T. The prevalence of iron deficiency anaemia in patients undergoing bariatric surgery. Obes Res Clin Pract 2015;9(1):45-49. Doi: 10.1016/j.orcp.2013.12.004
41. Stein J, Connor S, Virgin G, Ong DE, Pereyra L. Anemia and iron deficiency in gastrointestinal and liver conditions. World J Gastroenterol 2016;22(35):7908-7925. Doi: 10.3748/wjg.v22.i35.7908
42. Sultana GS, Haque SA, Sultana T, Ahmed AN. Value of red cell distribution width (RDW) and RBC indices in the detection of iron deficiency anemia. Mymensingh Med J 2013;22(2):370-376.
43. Peng YY, Uprichard J. Ferritin and iron studies in anaemia and chronic disease. Ann Clinb Biochem 2017;54(1):43-48. Doi: 10.1177/0004563216675185
44. Fitzsimons EJ, Brock JH. The anaemia of chronic disease. BMJ 2001;322(7290):811-812. Doi: 10.1136/bmj.322.7290.811
45. Wrighting DM, Andrews NC. Interleukin-6 induces hepcidin expression through STAT3. Blood 2006;108(9):3204-3209. Doi: 10.1182/blood-2006-06-027631
46. Kumon Y, Suehiro T, Nishiya K, Hashimoto K, Nakatani K, Sipe JD. Ferritin correlates with C-reactive protein and acute phase serum amyloid A in synovial fluid, but not in serum. Amyloid 1999;6(2):130-135. Doi: 10.3109/13506129909007314
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||