고혈압 환자의 뇌졸중 발병에 대한 소득 수준의 영향 및 약물 투약 순응도의 매개효과: 국민건강보험공단 표본코호트 연구
Abstract
Objectives
This study aimed to determine the associations between income level and stroke incidence in hypertensive patients. We also tried to measure the mediating effect of poor antihypertensive medication adherence through causal mediation analysis.
Methods
This study used the National Health Insurance Service National Sample Cohort Data from 2006 to 2015. The study population was newly diagnosed patients with hypertension aged 18 to 80. The associations between the independent-dependent variables, the mediator-dependent variables were confirmed with Cox proportional hazards regression models. In order to verify the mediating effect of poor hypertension medication adherence between income level and stroke occurrence, a weighting approach of causal mediation analysis method was used. Since age was the moderate variable, 18-49 years old and 50-80 years old were stratified.
Results
Under 50 years of age, all the other income groups had a significantly higher risk of poor medication adherence than the high-income group. For the patients aged 50 and older, the low-income group and the Medical Aid beneficiaries had a higher risk of poor medication adherence compared to the high-income group. In the patient under 50 years of age, the risk for the stroke incidence of the low-income group and the Medical Aid beneficiaries were higher than those in the high-income group. In the patients aged 50 and older, all the other income groups had a significantly higher risk of incidence of stroke. Causal mediation analysis showed that the mediated effect of poor medication adherence in all groups was not significant.
Conclusions
Low income significantly increased poor hypertension medication adherence and the incidence of stroke. The mediated effect of poor medication adherence was not significant.
Key words: Hypertension, Medication adherence, Stroke, Socioeconomic factor, Healthcare disparities
서 론
뇌졸중은 뇌경색, 뇌출혈, 지주막하 출혈 등 뇌혈관의 문제로 인한 중추신경계의 급성 국소 손상으로, 중요한 보건학 문제 중 하나이다[ 1]. 2016년 전 세계에서 약 1,370만 명의 새로 진단된 뇌졸중 환자가 발생하였고, 약 550만 명의 사람들이 사망했으며, 116.4만 장애보정손실년(disability-adjusted life years, DALYs)이 있었을 것으로 추정된다[ 2]. 세계에서 사망 원인 2위이며, 뇌졸중 발생 이후에는 장애보정손실연수 3위를 차지한다[ 3]. 뇌졸중은 발생 이후에 장애 등으로 인해 일시적, 또는 평생의 돌봄을 필요로 하게 되는 경우가 있고, 이는 본인뿐만 아니라 가족들에게까지 부담으로 작용할 수 있다[ 4]. 고혈압은 뇌졸중의 위험요인 중 하나이다[ 5, 6]. 기존의 연구에서 고혈압의 약물치료는 뇌졸중 발생을 감소시키는 것으로 알려져 있다[ 7, 8]. 고혈압과 같은 만성질환에서는 지속적으로 높은 투약순응도를 유지하면서 약을 복용하는 것이 중요하다. 이전 연구에서 투약순응도가 나쁜 고혈압 환자는 투약순응도가 좋은 환자에 비해 뇌졸중 위험이 27% 높았다[ 6]. 소득은 뇌졸중 발생에 중요한 사회적 결정요인 중 하나이면서, 고혈압을 비롯한 여러 질병의 약물 투약순응도에 영향을 미치는 것으로 알려져 있다[ 9, 10]. 이런 맥락에서, 투약 순응도가 소득에 따른 뇌졸중 발생에서 매개체 역할을 할 가능성이 있다고 가정할 수 있다. 그러나, 소득에 따른 뇌졸중 발생에서 투약 순응도의 매개 효과를 측정한 연구는 현재까지 없다. 본 연구에서는 뇌졸중의 주요 위험요소인 고혈압을 관리하는 방법 중 하나인 투약 순응이 소득 수준과 뇌졸중 발병 사이에서 매개 역할을 하는지 여부를 확인해 보고자 하였다. 또한, 인과 매개 분석 방법을 통하여 그 매개 효과를 측정하고자 하였다.
연구 방법
자료원
본 연구에서는 2006-2015년 국민건강보험공단의 표본코호트 The National Health Insurance Service-National Sample Cohort, NHIS-NSC) DB를 이용하였다[ 11]. 이 코호트 DB는 2006년 국민건강보험 가입자 및 의료급여 대상자 48,222,537명 중에서 무작위로 선정된 100만 명 이상의 표본 코호트로 구성되어 있다. 이 데이터베이스는 2002년부터 2015년까지 대상자의 의료비 청구 데이터를 토대로 각 개인의 의료 이용 내역을 제공한다. 데이터베이스가 2002-2005년 기간 동안 의료급여 수급자의 의료이용 내역은 포함하지 않았기 때문에, 본 연구에서는 2006-2015년의 데이터를 사용하였다. 국민건강보험 가입자는 직장가입자와 지역가입자로 나뉜다[ 12]. 국민건강보험은 가구별로 가구 대표에게 월 보험료를 받으므로, 각 가구의 대표와 부양가족으로 등록된 가족 구성원은 동일한 소득을 가진 것으로 간주된다. 모든 사업장의 근로자, 사업주는 직장가입자의 가구의 대표자로 등록된다. 각 가구의 대표자는 소득이 없거나 일정수준 이하인 가족구성원을 부양가족으로 등록할 수 있다. 본인 및 배우자의 형제 자매와 부모를 포함한 직계 가족은 함께 살지 않더라도 직장가입 가구 대표자의 부양 가족으로 등록할 수 있다. 직장가입자에 등록되지 않은 나머지 사람들은 지역가입자 범주에 포함된다. 지역가입자는 소유한 모든 소득과 재산이 건강보험료 부과체계에 모두 반영되므로, 월 소득 및 재산이 높을수록 더 많은 건강보험료를 납부한다. 반면, 직장가입자의 경우에는 직장에 등록된 소득 수준만 건강보험료 부과에 영향을 미치므로, 재산은 많으나 직장 소득이 낮은 경우에는 건강보험료가 낮게 부과될 수도 있다. 따라서 지역가입자는 직장가입자보다 개인의 소득 수준을 더 정확하게 반영한다[ 13]. 의료급여는 의료 서비스를 제공함으로서 저소득 가구의 최소 생계를 확보하기 위한 공적 지원 프로그램이다[ 14]. 일반적으로 의료급여 수급자는 국민건강보험의 저소득층보다 소득이 낮다. 의료급여 수급자는 국민기초생활법이 기준을 정하고 있으며, 의료급여 수급의 필수 요건은 모든 가정 구성원이 모두 직장에서 근로하지 않는 경우로, 소득인정액이 기준 중위소득의 100분의 40 이상인 경우이다. 본 연구에서는 가계 소득 및 재산 수준을 정확하게 분류하는 것이 중요하기 때문에 연구대상을 지역가입자와 의료급여 수급자로 제한하였다. 지역가입자의 경우 월 건강보험료는 가계 소득, 재산, 생활 수준 및 경제 활동 참여율에 따라 결정된다. 지역가입자는 국민건강보험공단에서 지정한 의료 서비스를 이용할 때 비용의 일정 부분을 지불한다[ 15]. 의료급여 수급자는 건강보험료를 내지 않으며, 정부가 지급하기 때문에 의료 상담 및 국민건강보험에서 지정한 의료서비스의 치료 비용을 거의 또는 전혀 내지 않는다[ 12].
연구대상
연구대상은 2008년 1월 1일 이후 처음으로 고혈압 진단을 받고 두 번 이상 고혈압 약을 처방받은 18세 이상, 80세 이하 환자였다. 2006-2007년 wash-out 기간 동안 고혈압으로 의료기관을 방문했던 환자들은 제외하였다. 고혈압 진단 전 뇌졸중 진단이 없었음을 확인하기 위해 2006년 1월 1일부터 첫 고혈압 진단일까지 뇌졸중 치료 기록이 없음을 확인하였다. 고혈압의 기준은 진단명에 국제질병분류(International Classification of Disease, Tenth Edition, ICD) 코드 I10-I15를 포함한 경우로 하였다[ 6]. 항고혈압 약물은 해부 ·치료·화학적 분류(Ana-tomical Therapeutic Chemical [ATC] classification) 코드 “ C02, C03, C07, C08, C09”로 정의하였다[ 16]. 환자 중 총 항고혈압 약물의 처방일이 30일 이하인 경우는 제외하였다. 자료원에서 서술하였던 것처럼, 정확한 소득 수준의 적용을 위하여, 건강보험 가입자 중 지역가입자와 의료급여 수급자를 대상으로 분석을 수행하였다. 또한, 장애 정도와 소득 수준을 확인할 수 없는 환자는 제외하였다. 분석 기간 동안 새로 진단받은 고혈압으로 고혈압 약을 두 번 이상 처방받은 18세 이상, 80세 이하의 환자는 74,863명이었다. 항고혈압 약물의 처방일이 30일 이하인 환자(n=7,566), 직장가입자(n=40,932), 장애 정도와 소득 수준을 확인할 수 없는 환자(n=53)를 제외하여, 총 26,312명의 환자를 분석하였다.
분석모델과 변수
Figure 1.
Analysis model. CCI, Charlson comorbidity index. 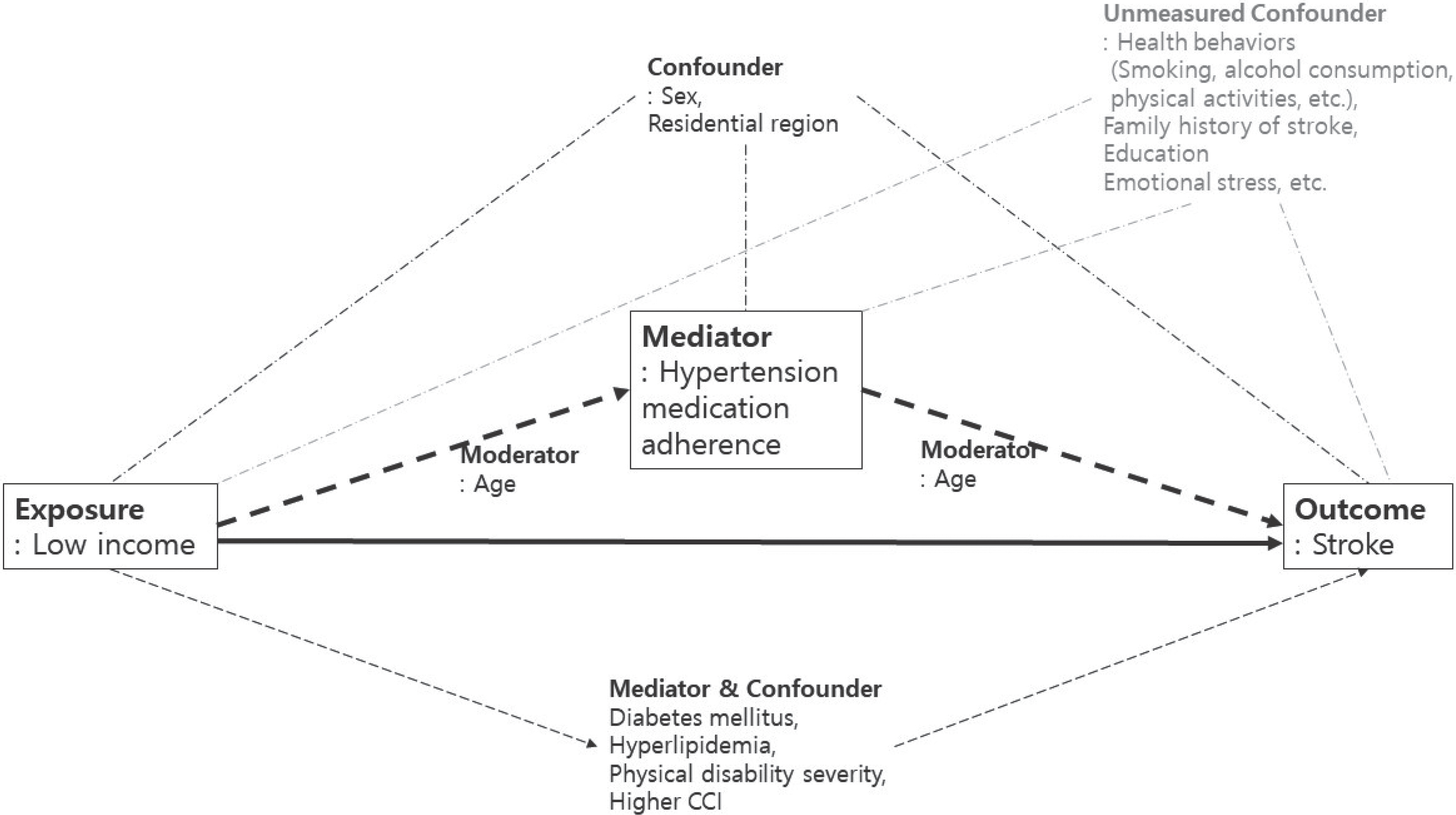
연구 대상은 18세 이상, 80세 이하의 고혈압 약을 처방받고 고혈압을 진단받은 환자로, 독립변수는 소득수준이며, 결과변수는 뇌졸중의 발생이다. 이 모델에서 고혈압 약의 투약순응도는 매개체로 작용한다. 즉, 독립변수인 소득수준의 결과이며, 결과변수인 뇌졸중 발생의 원인이 된다.
공변수는 결과변수의 변동성을 설명할 수 있는 변수이며, 공변수 중에서 결과변수의 원인이 되면서, 독립변수와는 인과관계에 있지 않으나 연관성이 있는 것을 교란변수라 한다. 이 모델에서 당뇨, 이상지질혈증, 동반질환여부, 장애 정도는 또 다른 매개체이자 교란변수이다. 이 모델에서 또 다른 교란변수로서 성별과 주거지역이 있다. 연령은 조절변수로 작용한다( Table 1, Figure 1).
Table 1.
Demographics of the study population
|
Variables |
Total |
Income level |
p-value |
|
High |
Middle |
Low |
Medical Aid beneficiaries |
|
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
|
Total |
26,312 |
100.0 |
9,593 |
100.0 |
7,449 |
100.0 |
6,471 |
100.0 |
2,799 |
100.0 |
|
|
Sex |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
Female |
12,079 |
45.9 |
4,178 |
43.6 |
3,334 |
44.8 |
3,036 |
46.9 |
1,531 |
54.7 |
|
|
Age (y) |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
18-33 |
683 |
2.6 |
210 |
2.2 |
194 |
2.6 |
216 |
3.3 |
63 |
2.3 |
|
|
34-49 |
8,439 |
32.1 |
2,890 |
30.1 |
2,742 |
36.8 |
2,120 |
32.8 |
687 |
24.5 |
|
|
50-65 |
12,221 |
46.4 |
5,022 |
52.4 |
3,354 |
45.0 |
2,823 |
43.6 |
1,022 |
36.5 |
|
|
66-80 |
4,969 |
18.9 |
1,471 |
15.3 |
1,159 |
15.6 |
1,312 |
20.3 |
1,027 |
36.7 |
|
|
Residential area |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
Metropolitan |
11,805 |
44.9 |
4,483 |
46.7 |
3,202 |
43.0 |
2,902 |
44.8 |
1,218 |
43.5 |
|
|
Urban |
11,583 |
44.0 |
4,237 |
44.2 |
3,365 |
45.2 |
2,831 |
43.7 |
1,150 |
41.1 |
|
|
Rural |
2,924 |
11.1 |
873 |
9.1 |
882 |
11.8 |
738 |
11.4 |
431 |
15.4 |
|
|
CCI |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
≤2 |
8,791 |
33.4 |
3,261 |
34.0 |
2,813 |
37.8 |
2,223 |
34.4 |
494 |
17.6 |
|
|
3-5 |
12,422 |
47.2 |
4,810 |
50.1 |
3,425 |
46.0 |
2,947 |
45.5 |
1,240 |
44.3 |
|
|
≥6 |
5,099 |
19.4 |
1,522 |
15.9 |
1,211 |
16.3 |
1,301 |
20.1 |
1,065 |
38.0 |
|
|
Physical disability severity |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
None |
24,253 |
92.2 |
9,200 |
95.9 |
7,095 |
95.2 |
5,968 |
92.2 |
1,990 |
71.1 |
|
|
Mild |
470 |
1.8 |
47 |
0.5 |
47 |
0.6 |
64 |
1.0 |
312 |
11.1 |
|
|
Moderate and severe |
1,589 |
6.0 |
346 |
3.6 |
307 |
4.1 |
439 |
6.8 |
497 |
17.8 |
|
|
Diagnosis of DM |
14,509 |
55.1 |
5,158 |
53.8 |
3,864 |
51.9 |
3,584 |
55.4 |
1,903 |
68.0 |
<0.01 |
|
Diagnosis of dyslipidemia |
21,287 |
80.9 |
7,892 |
82.3 |
5,906 |
79.3 |
5,095 |
78.7 |
2,394 |
85.5 |
<0.01 |
|
CMA |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
Good (≥50%) |
21,700 |
82.5 |
8,165 |
85.1 |
6,184 |
83.0 |
5,158 |
79.7 |
2,193 |
78.3 |
|
|
Poor (<50%) |
4,612 |
17.5 |
1,428 |
14.9 |
1,265 |
17.0 |
1,313 |
20.3 |
606 |
21.7 |
|
|
Stroke events |
|
|
|
|
|
|
|
|
|
|
<0.01 |
|
Total |
1,454 |
5.5 |
398 |
4.1 |
352 |
4.7 |
360 |
5.6 |
344 |
12.3 |
|
|
Hemorrhagic |
205 |
0.8 |
64 |
0.7 |
49 |
0.7 |
51 |
0.8 |
41 |
1.5 |
|
|
Ischemic |
1,322 |
5.0 |
355 |
3.7 |
320 |
4.3 |
328 |
5.1 |
319 |
11.4 |
|
독립변수인 소득에 대하여, 우리는 2008년의 소득수준이 이후에 변화가 없다는 가정을 하고, 2008년의 소득 기록을 활용하였다. 국민건강보험공단 표본 코호트는 가구의 소득 수준에 따라 지역가입자의 소득을 10분위로 나누며, 데이터에서는 각 개인이 이 10분위 중 어디에 속하는지를 확인할 수 있다. 의료급여 수급자는 따로 분류된다. 본 연구에서는 소득수준을 네 그룹으로 분류하였다. 소득수준이 상위 1-3분위에 속하는 경우를 고소득, 상위 4-6분위에 속하는 경우를 중간 소득, 7-10분위에 속하는 경우를 저소득, 그리고 의료급여 수급자로 분류하였다.
매개변수인 고혈압 약의 투약순응도를 정의하기 위해, 본 분석에서는 투약순응도를 측정하는 여러 지표 중에서 누적 약물 순응도(Cu-mulative Medication Adherence, CMA)를 사용하였다. CMA를 계산하는 식은 아래와 같다[ 17]. 투약순응도는 100%를 넘을 수 없으므로, 수치가 100 이상의 값이 나오면 100으로 간주하였다. 기존 연구에서 CMA를 각각 25%, 50%, 75%를 기준으로 집단을 분류하여 뇌혈관질환 발생 여부를 관찰하였을 때, 50% 이하인 그룹과 51% 이상인 그룹 사이에서 뇌혈관질환 발생의 차이가 유의하게 있던 점을 고려하여, CMA가 50% 이상인 경우를 투약순응도가 좋은 것으로, 50% 미만인 것을 투약순응도가 나쁜 것으로 정의하였다[ 18]. 그러나 투약순응도를 어떻게 정의하느냐에 따라 결과가 달라질 수 있음을 고려하여 추가적으로 CMA 70%, 75%, 80%, 90%를 기준으로 투약순응도의 좋고 나쁨을 정의하여 매개변수로 하고 민감도분석을 수행하였다. 결과 변수인 뇌졸중의 발생은 진단명에 ICD 코드 I60-I63을 포함하는 경우로 정의하였다[ 19]. 또 다른 매개체이자 교란변수인 당뇨, 이상지질혈증, 동반질환은 아래와 같이 정의하였다. 당뇨는 의료이용 기록의 진단명에서 ICD 코드 E10-14를 포함한 경우, 이상지질혈증은 의료이용 기록의 진단명에서 E78을 포함하는 경우로 하였다. 동반질환은 Charlson 동반질환지수(Charlson Comorbidity Index, CCI)를 사용하였다. CCI는 고혈압을 처음 진단받기 2년 전부터 처음 진단받은 날까지의 기간 동안의 의료이용 기록의 진단명 ICD 코드를 이용하여 측정하였다[ 20]. 당뇨는 중요 교란변수로 따로 보정하였으므로, 이 분석에서 사용한 CCI 변수에는 당뇨병 진단은 포함하지 않았다. 주거지역은 고혈압을 처음 진단받은 해의 주거지역기록을 이용하여 대도시, 도시, 시골 지역으로 구분하였다. 주거지역이 특별시 및 광역시에 속하는 경우를 대도시로, 시 지역에 속하는 경우를 도시로, 군 지역에 속하는 경우를 시골 지역으로 구분하였다.
분석 모델에 나타낸 것처럼 연령은 독립변수와 매개변수 사이에서도 조절변수로 작용하며, 매개변수와 결과변수 사이에서도 조절변수로 작용한다. Figure 2에서 나타난 것처럼, 소득에 따른 연령별 CMA의 중간값은 50-55세를 기준으로 변곡하는 양상을 보였다. 또한, 기존의 여러 연구에서 45세 또는 49세 이하의 젊은 환자의 뇌졸중은 그 이상 연령대의 뇌졸중과 구분하여 분석된다[ 21– 23]. 그러므로 본 연구에서는 조절변수의 효과를 고려하여, 주요 분석은 50세를 기준으로 층화분석을 하였으며, 각 층화 분석에서도 연령은 연속변수로서 보정하였다.
Figure 2.
The median value of cumulative medication adherence (CMA) by age according to the income level. 
Figure 1에서와 같이 분석에 이용한 데이터에서 확인할 수 없는 또 다른 교란변수로는 흡연, 운동량, 비만 등의 건강행태, 뇌졸중의 가족력, 교육수준, 스트레스 등이 있다. 분석에 사용한 국민건강보험공단 표본 코호트는 대상자의 국민건강검진 자료 또한 제공하나, 국가검진이 의무사항이 아니어서, 연구 대상 중 뇌졸중 발생 전 건강검진을 받지 않은 사람이 24.2%이었다. 또한, 소득이 낮을수록 국민건강검진의 수진율이 급격히 낮아지기 때문에, 건강검진 자료를 분석에 사용하는 것은 심각한 선택 바이어스(bias)의 우려가 있다[ 24]. 그러므로, 본 연구에서는 건강행태 및 뇌졸중의 가족력 변수를 주요 분석에는 포함하지 않았으며, 다중대체 방법을 통하여, 흡연(비흡연/흡연/과거흡연), 비만(체질량지수 25 미만/이상), 뇌졸중의 가족력, 신체활동(1주 운동횟수 3회 이상/미만) 변수를 추가 보정하여 인과 매개 분석에 대한 민감도 분석을 시행하고 주요 분석결과와 비교하였다.
통계분석
우선,기본 역학적 특성을 빈도 및 백분율로 정리하고, 카이제곱 검정을 수행하였다.
매개 효과 분석을 수행하기 전에 다항 로지스틱 회귀 모형을 사용하여 소득 수준(독립 변수)과 투약순응도(매개변수)의 연관성을 확인하였다.
전통적인 매개 효과 분석은 매개변수를 포함하지 않은 모델과 매개 변수를 포함한 모델의 추정치를 비교하여 매개 효과의 비율을 계산하는 것이었다[ 25]. 그러나 많은 연구자들은 (1) 매개변수-결과변수 교란, (2) 독립변수-매개변수의 상호작용, (3) 독립변수에 의해 영향을 받는 매개변수-결과변수 등의 이유 때문에 전통적인 접근방식이 매개체의 실제 효과를 과대평가하거나 과소평가할 수 있다고 보고하였다[ 26– 28]. 따라서, 이를 극복할 수 있는 반사실적 체계에 기초한 인과 매개 분석방법을 사용하였다. 본 연구에서는 콕스(Cox) 비례 위험 모델을 이용한 생존분석을 수행하였는데, 이 모델에 대한 반사실적 체계 접근법을 적용하기 위해, Lange et al. [ 29]이 사용한 방법인 가중치 접근방식을 사용하였다. 분석은 SAS 엔터프라이즈 가이드 버전 7.1 (SAS Institute Inc., Cary, NC, USA)을 사용하였다. 로지스틱 회귀분석과 콕스 비례 위험 모델을 이용한 생존분석에서 각각 교란변수인 성별, 연령, 거주 지역, 당뇨 진단 여부, 이상지질혈증 진단 여부, 장애 정도, CCI를 보정하였다.
윤리 성명
본 연구는 서울대학교의 연구윤리위원회에 의해 승인되었다(IRB No.: E1808/003-002).
연구 결과
총 26,312명의 고혈압 환자를 118,919 person-year 추적관찰 하였다.
Table 1은 소득에 따른 주요 변수들의 역학적 분포를 보여준다. 지역 가입자의 모든 그룹에서 남성의 비율이 높았으나, 의료급여 수급자에서는 여성의 비율이 높았다. 50-80세 연령층의 비율은 전체적으로는 65.3%이었으며, 의료급여에서는 73.2%이었다. 뇌졸중의 발생은 소득수준이 낮아질수록 높아졌다.
Table 2는 소득수준을 독립 변수, 나쁜 투약순응도를 결과변수로 하였을 때의 다항 로지스틱 회귀분석 결과를 보여준다. 연령별로 층화하여 분석하였을 때, 50세 미만에서는 모든 소득층에서 고소득층에 비해 나쁜 투약순응도의 위험이 높았다. 중간소득층은 1.22배(95% confidence interval, CI: 1.08-1.39), 저소득층은 1.49배(95% CI: 1.31-1.70), 의료급여 수급자는 1.30배(95% CI: 1.06-1.61)로, 높은 위험의 교차비를 보였다. 50세 이상에서는 중간소득층은 유의한 차이를 보이지 않았으며, 저소득층은 나쁜 투약순응도의 위험이 1.35배(95% CI: 1.21-1.50), 의료급여 수급자는 1.66배(95% CI: 1.45-1.91) 높았다.
Table 2.
Results of logistic regression analysis for poor medication adherence
|
Variables |
Hypertension patients |
CMA <50% |
Rate |
Adjusted OR
(95% CI) |
|
n |
n |
% |
|
Age <50 |
|
|
|
|
|
High income |
3,100 |
562 |
18.1 |
Reference |
|
Middle income |
2,936 |
635 |
21.6 |
1.22 (1.08-1.39) |
|
Low income |
2,336 |
598 |
25.6 |
1.49 (1.31-1.70) |
|
Medical Aid beneficiaries |
s 750 |
171 |
22.8 |
1.30 (1.06-1.61) |
|
Age ≥50 |
|
|
|
|
|
High income |
6,493 |
866 |
13.3 |
Reference |
|
Middle income |
4,513 |
630 |
14.0 |
1.04 (0.93-1.16) |
|
Low income |
4,135 |
715 |
17.3 |
1.35 (1.21-1.50) |
|
Medical Aid beneficiaries |
s 2,049 |
435 |
21.2 |
1.66 (1.45-1.91) |
Table 3은 연령으로 층화하였을 때, 각 층에서 소득수준에 따른 뇌졸중 발생에 대한 콕스 비례위험모형을 이용한 생존분석 결과를 보여준다. 모델 1에서 성별, 연령, 거주지역, CCI, 장애 정도, 당뇨진단, 이상지질혈증진단 여부를 보정하였고, 모델 2에서는 추가로 투약순응도를 보정하였다. 모델 1과 모델 2에서의 분석 결과는 비슷하였다. 모델 2에서의 50세 미만에서는 중간소득층은 고소득층에 비해 유의한 조정 위험 비율(adjusted hazard ratio, aHR)의 차이는 없었으며, 저소득층은 1.61배(95% CI: 1.15-2.27), 의료급여 수급자는 2.55배(95% CI: 1.66-3.90) 뇌졸중 발생의 위험이 높았다. 50세 이상에서는 중간소득, 저소득, 의료급여 수급자 모두 고소득에 비해 뇌졸중 발생의 위험이 높았다[중간소득 aHR 1.21 (95% CI: 1.03-1.42); 저소득 aHR 1.24 (95% CI: 1.06-1.46); 의료급여 수급자 aHR 1.93 (95% CI: 1.63-2.28)]. 모델 2에서 보이는 것처럼, 18-49세 고혈압 환자에서는 나쁜 투약순응도가 유의하게 뇌졸중의 위험을 1.37배(95% CI: 1.04-1.81) 높이지만, 50-80세에서는 투약순응도의 유의한 연관이 없었다(aHR 0.99; 95% CI: 0.86-1.15).
Table 3.
Results of Cox regression analysis for stroke incidence
|
Variables |
Hypertension patients |
Stroke |
Stroke incidence |
Model 1 |
Model 2 |
|
n |
n |
% |
Adjusted HR
(95% CI) |
Adjusted HR
(95% CI) |
|
Age <50 |
|
|
|
|
|
|
High income |
3,100 |
63 |
2.0 |
Reference |
Reference |
|
Middle income |
2,936 |
70 |
2.4 |
1.24 (0.88-1.75) |
1.23 (0.87-1.73) |
|
Low income |
2,336 |
72 |
3.1 |
1.65 (1.17-2.32) |
1.61 (1.15-2.27) |
|
Medical Aid beneficiaries |
750 |
42 |
5.6 |
2.58 (1.69-3.96) |
2.55 (1.66-3.90) |
|
Poor medication adherence |
|
|
|
- |
1.37 (1.04-1.81) |
|
Age ≥50 |
|
|
|
|
|
|
High income |
6,493 |
335 |
5.2 |
Reference |
Reference |
|
Middle income |
4,513 |
282 |
6.2 |
1.21 (1.03-1.42) |
1.21 (1.03-1.42) |
|
Low income |
4,135 |
288 |
7.0 |
1.24 (1.06-1.46) |
1.24 (1.06-1.46) |
|
Medical Aid beneficiaries |
2,049 |
302 |
14.7 |
1.92 (1.63-2.28) |
1.93 (1.63-2.28) |
|
Poor medication adherence |
|
|
|
|
0.99 (0.86-1.15) |
Table 4는 반사실적 체계에 기초한 가중치 접근 인과 매개 분석 결과이다. 이 결과 모든 그룹에서 투약순응도의 매개효과는 유의하지 않은 것으로 나타났다.
Table 4.
Results of causal mediation analysis
|
Income level |
Adjusted HR |
p-value |
|
Age <50 |
|
|
|
High income |
Reference |
|
|
Middle income: natural direct effect |
1.23 (1.04-1.46) |
0.02 |
|
Low income: natural direct effect |
1.61 (1.35-1.91) |
<0.01 |
|
Medical Aid beneficiaries: natural direct effect |
2.60 (2.09-3.22) |
<0.01 |
|
Middle income: natural indirect effect |
1.01 (0.85-1.21) |
0.91 |
|
Low income: natural indirect effect |
1.02 (0.86-1.22) |
0.80 |
|
Medical Aid beneficiaries: natural indirect effect |
1.02 (0.85-1.21) |
0.87 |
|
Age .50 |
|
|
|
High income |
Reference |
|
|
Middle income: natural direct effect |
1.22 (1.12-1.32) |
<0.01 |
|
Low income: natural direct effect |
1.24 (1.15-1.35) |
<0.01 |
|
Medical Aid beneficiaries: natural direct effect |
1.93 (1.77-2.10) |
<0.01 |
|
Middle income: natural indirect effect |
1.00 (0.92-1.08) |
1.00 |
|
Low income: natural indirect effect |
1.00 (0.92-1.08) |
0.99 |
|
Medical Aid beneficiaries: natural indirect effect |
1.00 (0.92-1.08) |
0.99 |
투약순응도의 좋고 나쁨의 기준을 70%, 75%, 80%, 90% 기준으로 재정의하여 매개 분석을 수행하였을 때에도 모든 경우에서 모든 그룹의 투약순응도의 매개효과가 유의하지 않은 것으로 나타났다( Supplementary Table 3). 다중 대체 방법을 통하여 흡연, 비만, 신체활동, 뇌졸중의 가족력을 추가 보정하여 수행한 인과 매개 분석에 대한 민감도 분석을 수행하였다( Supplementary Table 4). 각 변수의 결측치는 흡연 23.2%, 비만 21.8%, 신체활동 24.3%, 뇌졸중의 가족력 40.0%이었다. 분석 결과에서, 모든 그룹에서 투약순응도의 매개효과는 유의하지 않은 것으로 나타났다.
고찰 및 결론
연구 결과, 고혈압 환자에서 소득이 낮을수록 나쁜 투약순응도의 위험은 높았고, 뇌졸중 발생의 위험 또한 높았다. 투약순응도는 18-49세에서는 전체 뇌졸중 발생의 위험을 유의하게 높였으나, 투약순응도의 매개 효과는 18-49세, 50-80세에서 모두 유의하지 않았다.
약물이 질병의 발생을 예방하는 정도를 측정할 때, 이상적이거나 통제적인 조건을 가정한 약물의 효능뿐만 아니라, 실제 현실에서 어떻게 작용할 지를 나타내는 효과 또한 고려해야 한다[ 30]. 투약순응도는 약물의 효과를 측정하는 데 주요 요소가 된다. 본 연구는 투약순응도를 통해 약물의 효과가 소득수준에 따라 다르게 나타날 수 있음을 보여주었으며, 효과의 크기가 연령에 따라 다를 수 있음을 보여주었다. 연구 결과, 18-49세에서 독립변수인 소득계층과 매개변수인 투약순응도의 관계는 유의하였고, 독립변수와 결과변수인 뇌졸중 발생의 관계도 유의하였다. 또한 매개변수와 결과변수의 관계도 유의하였다. 그러나 투약순응도의 매개효과는 유의하지 않은 것으로 나타났다. 인과 매개 분석에서 매개 효과가 제대로 나타나지 않을 경우는 두 가지를 고려해 볼 수 있다. 첫째, 단일 매개체로 가정한 분석 모델보다 다중매개모델을 통해 더 잘 설명되는 경우 매개 효과가 과소평가될 가능성이 있다. 기존의 연구에서, 독립변수인 CHRNA5-A3 유전자와 결과변수인 폐암의 연관에서, 흡연을 단일 매개체로 가정하였을 때는 흡연의 매개 효과는 5%에 불과하였으나, 다중 매개 모델을 이용하였을 때는 흡연을 통한 매개 효과가 18%까지 측정되었다[ 31]. 이러한 잘못된 분석결과는 주로 환자-대조군 연구에서 환자군과 대조군이 각각의 하위 모집단과 다른 비율로 선택될 때 발생한다[ 32]. 본 연구는 코호트 연구이기 때문에 이와 같은 샘플링의 오류가 발생할 확률이 매우 적으므로, 이 같은 문제가 발생했을 가능성이 적다. 둘째, 어떤 연구자들은 시간의 흐름에 따른 변동을 충분히 포착하지 못하는 연구에서는 매개 분석이 실패할 가능성이 높다고 주장하였다[ 33]. 본 연구에서 계산한 투약순응도는 추적 기간 동안의 투약순응도의 평균값이므로, 추적기간동안 투약순응도의 변동을 제대로 반영을 못했을 가능성도 있다. 그러나, 기존의 연구에서 약물의 투약순응도를 2년 단위로 경과관찰 하였을 때 큰 변화가 없었던 점을 고려한다면, 시간의 흐름에 따라 크게 변동하지 않았을 것으로 예상한다[ 34]. 이러한 점들을 고려한다면, 본 연구에서 매개효과가 유의하지 않게 나타난 것은 실제 현실을 반영한 것으로, 투약순응도는 소득수준과 뇌졸중 발생 사이에서 매개체 보다는 교란변수의 역할을 하는 것으로 해석할 수 있다. 즉 투약순응도는 소득수준과 뇌졸중 둘 다와 관련이 있으나, 둘 사이의 인과 과정 위에 있지는 않은 것으로 생각된다[ 35]. 추가 분석으로 전통적인 방법으로 매개 효과를 측정하였을 때 18-49세에서, 저소득층에서, 투약순응도의 매개 효과가 유의하며, 매개 비율이 20.6%로 추정되었다. 그러나, 반사실적 체계에 기초하여 분석하였을 때 세 그룹 모두 투약순응도의 매개 효과는 유의하지 않은 것으로 나타났다. 그 이유는, 방법에서 서술했던 것처럼, 본 연구에서 반사실적 체계에 기초한 매개 분석을 수행한 이유로 설명할 수 있다[ 26– 28]. 첫째, 독립변수-매개변수의 상호작용 때문이다. 추가 분석에서 매개변수를 각각 좋은 투약순응도와 나쁜 투약순응도로 고정하여 분석을 하였을 때, 독립변수가 결과변수에 미치는 영향의 크기는 변화하였으며, 이를 볼 때 독립변수와 매개변수 간에 상호작용이 있음을 확인할 수 있었다. 고전적인 매개 분석 방법을 통해 얻은 직접효과에서는 소득수준과 연관되어 투약순응도가 좋은 경우의 효과가 제거된다. 그러므로 상대적으로 간접효과가 더 크게 보일 수 있게 된다. 둘째, 독립변수에 의해 영향을 받는 매개변수-결과변수의 교란 때문이다. 본 연구에서는 성별과 주거지역, 나이를 교란변수로서 분석모델에서 보정하였다. 이들 교란변수는 매개변수, 결과변수뿐만 아니라, 독립변수와도 관련이 있다. 그러므로, 성별, 주거지역, 나이를 보정하는 것은 독립변수인 소득 자체가 결과변수에 미치는 영향을 더 작게 보이도록 만들 수 있다. 본 연구에서는 연령이 조절변수로 작용하여, 18-49세와 50-80세에서 각각 다른 분석결과를 확인할 수 있었다. 소득수준에 따른 투약순응도는 50세 미만에서는 모든 그룹에서 유의하였으나, 50세 이상에서는 중간소득 층에서는 유의하지 않았다. 소득수준에 따른 뇌졸중 발생에 대한 생존 분석 결과에서 투약순응도는 18-49세에서만 유의하고, 50-80세에서는 유의하지 않았다.
본 연구에서는 소득수준에 따른 뇌졸중 발생 위험 격차는 50세 이상인 경우보다 50세 미만인 경우에 더 높은 것으로 확인되었다. 50세 이상 의료급여 수급자는 50세 이상 고소득자에 비해 뇌졸중 발생 위험이 1.93배 높아 이 또한 높은 수치였다. 그러나, 50세 미만 의료급여 수급자는 50세 미만 고소득자에 비해 뇌졸중 발생 위험이 무려 2.55배였다. 다른 여러 연구에서도 상대적으로 노년층에서 건강 불평등은 그 격차가 줄어드는 것처럼 보이는 것으로 나타났다[ 36– 38]. 이에 대한 여러 학설이 있는데, 그 중 Aging-as-leveler hypothesis는 건강불평등이 나이가 듦에 따라, 특히 중년 이후로 격차가 줄어든다는 주장하는 이론으로, 그 이유를 사망 선택과, 혜택 받은 집단의 늦은 질병 발병으로 설명한다[ 39, 40]. Aging-as-leveler hypothesis를 고려한다면, 본 연구 결과를 단지 나이가 들면 건강불평등의 정도가 줄어드는 것의 예로 해석할 수 만은 없다. 그러나, 젊은 나이의 뇌졸중 발생이 소득에 큰 영향을 받는다는 사실 그 자체만으로 중요한 시사점이 있다. 뇌졸중은 합병증 및 재발 예방을 위해 꾸준한 관리가 필요한 병으로, 뇌졸중이 발생하면 취업, 노동 등에 불이익을 얻게 되기 때문에 더 가난해지고 악순환이 될 가능성이 높아진다[ 41, 42]. 본 연구 결과는 젊은 연령대에서 소득으로 인한 뇌졸중 발생의 격차를 줄이기 위한 노력이 필요하다는 것을 보여준다. 위에서 서술한 것처럼 투약순응도는 소득수준과 뇌졸중의 발생 사이에서 교란변수의 역할을 하는 것으로 예상되며, 본 연구 결과 50세 이상의 성인과 달리 50세 미만 성인에서는 나쁜 투약순응도가 뇌졸중 발생의 위험을 1.37배 유의하게 높이는 것으로 나타났다. 그러므로, 저소득층의 젊은 연령층을 대상으로 하여 투약순응도를 높이기 위한 추가적인 노력이 필요하다. 예를 들어, 유급 휴가를 통해 치료순응도를 높이는 등의 정책을 고려할 수 있을 것이다[ 43]. 본 연구는 몇 가지 강점이 있다. 첫째, 고전적 매개 분석이 아닌 인과 매개 분석을 수행함으로써, 투약순응도의 매개 효과를 보다 정확하게 측정할 수 있었다. 둘째, 분석에 사용한 국민건강보험공단 표본 코호트 자료의 일부는 우리나라 전체 지역가입자를 대표할 수 있는 데이터이다. 셋째, 본 데이터에서는 전체 개체의 0.08%에 해당하는 20명의 환자만이 연구 기간의 마지막 해인 2015년 이전에 추적 중단이 되었으므로 추적 경과 관찰의 완결성이 뛰어나다. 넷째, 본 연구는 개별 환자의 소득 수준을 측정할 때에 이를 보다 정확하게 반영하는 실제 보험료 10분위를 사용하였다.
본 연구는 또한 몇 가지 제한점이 있다. 첫째, 분석에서 흡연, 운동량, 체질량지수와 같은 건강행태 관련 변수, 뇌졸중의 가족력, 스트레스, 교육수준과 같은 변수를 보정하지 않았다. 반사실적 체계에 근거한 매개 분석에서는 가급적 통제되지 않는 교란변수가 없도록 해야 하나, 사실상 이것은 불가능하다. 본 연구에서 추가 분석으로 건강검진 자료의 흡연, 비만, 운동량, 뇌졸중의 가족력 변수를 추가하고, 결측값을 다중 대체 방법을 이용하여 보정하여 분석하였을 때 주요 분석결과와 큰 차이가 없었다. 또한, 기존에 출판된 투약순응도가 뇌졸중 발생에 미치는 영향에 대한 연구에서도 건강행태 관련 변수를 보정한 민감도 분석에서의 결과가 큰 차이가 없었다[ 6]. 이를 고려하면, 본 연구에서 건강행태 관련 변수를 보정하지 않은 것은 결과에 큰 영향을 미치지 않았을 것이라고 예상한다. 둘째, 소득수준이 2008년 이후 변화하지 않았을 것으로 가정하고 개인의 소득수준을 분류하였으므로, 소득이 그 이후 변화하였을 가능성이 있다. 셋째, 저소득층과 일부 의료급여 수급자 그룹의 소득 추계에서 오류의 가능성이 있다. 의료급여 수급자 중 일부는 국가유공자, 국가무형문화재 보유자 등 국민기초생활법 외 타법 적용으로 의료급여가 적용된 경우이며, 이들의 소득인정액 기준은 국민기초생활법에 비해 기준이 느슨하다. 그러므로, 본 연구에 포함된 의료급여 수급자 중에 일부 저소득층에 비해 소득이 더 낮지 않은 자가 포함되었을 가능성이 있다. 만약 그와 같은 가능성을 고려한다면, 실제에서는 저소득층과 의료급여 수급자의 건강 결과가 본 연구결과 보다 더 크게 차이가 날 가능성이 있다. 넷째, 투약순응도를 개인이 처방전을 받은 기록을 바탕으로 계산하였으므로, 이 값은 실제로 환자가 약을 복용한 것과 다를 가능성이 있다. 본 연구 결과는 저소득층에서 투약순응도를 높이려는 정책적인 노력이 필요함을 보여준다. 본 연구결과에서 고혈압 약의 투약순응도가 유의한 매개효과를 나타내지는 않았으나, 높은 투약순응도는 그 자체로 뇌졸중, 심혈관계 질환을 예방하는 효과가 있다[ 18]. 또한, 고혈압 약물 투약순응도가 나쁜 환자라면 당뇨, 이상지질혈증 등 다른 만성 질환의 약물 투약순응도도 나쁠 가능성이 높다. 기존의 연구에서 저소득층 환자의 경우 약물에 대한 오해와 정보 부족 및 의사 결정에서 배제되는 것이 투약순응도를 높이는 데 장애가 된다고 했으므로, 이 과정에서 환자가 충분히 약 복용을 할 수 있도록 지지하고, 가급적 약물의 조합을 줄이는 등 저소득층 환자의 약물 투약순응도를 높이기 위한 노력이 필요할 것이다[ 44, 45]. 국민건강보험공단의 다제약물 관리사업을 저소득층, 의료급여 수급자 등을 우선 대상으로 진행하는 방안 등을 고려할 수 있을 것이다. 본 연구 결과 소득이 낮을수록 고혈압환자의 투약순응도는 나빴으며, 또한 뇌졸중의 발생 위험도 높아졌다. 그러나 고혈압환자의 소득에 따른 뇌졸중의 발생 위험에서 투약순응도의 유의한 매개 효과는 확인할 수 없었다. 연령은 소득에 따른 투약순응도, 뇌졸중의 발생에서 조절변수로 작용하였다.
향후 저소득층에서 투약순응도에 영향을 미치는 요소에 관한 연구가 필요하다. 또한 본 연구에서는 소득수준과 뇌졸중의 발생 사이에서 매개 역할을 하는 매개 요소 및 중개자를 탐색하기 위한 추가 연구가 필요하다.
Supplementary Material
Supplementary Table 3.
Results of sensitivity analysis in various definitions of poor medication adherence
jhis-47-4-268-suppl3.pdf
REFERENCES
1. Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJB, Culebras A, et al. An updated definition of stroke for the 21st century: a state-ment for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2013;44(7):2064-2089. DOI: 10.1161/STR.0b013e318296aeca.   3. Mansfield A, Inness EL, Mcilroy WE. Stroke. Handb Clin Neurol 2018;159:205-228. DOI: 10.1016/B978-0-444-63916-5.00013-6.   7. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JLJ, et al. The seventh report of the Joint National Committee on Pre-vention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003;289(19):2560-2572. DOI: 10.1001/jama. 289.19.2560.   11. Lee J, Lee JS, Park SH, Shin SA, Kim KW. Cohort profile: The National Health Insurance Service-National Sample Cohort (NHIS-NSC), South Korea. Int J Epidemiol 2017;46(2):e15. DOI: 10.1093/ije/dyv319.   12. Song YJ. The South Korean health care system. JMAJ 2009;52(3):206-209.
22. Boot E, Ekker MS, Putaala J, Kittner S, De Leeuw FE, Tuladhar AM. Ischaemic stroke in young adults: a global perspective. J Neurol Neu-rosurg Psychiatry 2020;91(4):411-417. DOI: 10.1136/jnnp-2019-322424.   25. Baron RM, Kenny DA. The moderator-mediator variable distinction in social psychological research: conceptual, strategic, and statistical considerations. J Pers Soc Psychol 1986;51(6):1173-1182. DOI: 10. 1037/0022-3514.51.6.1173.   26. Richiardi L, Bellocco R, Zugna D. Mediation analysis in epidemiology: methods, interpretation and bias. Int J Epidemiol 2013;42(5):1511-1519. DOI: 10.1093/ije/dyt127.   27. Imai K, Keele L, Tingley D. A general approach to causal mediation analysis. Psychol Methods 2010;15(4):309-334. DOI: 10.1037/a0020761.   28. VanderWeele TJ. Mediation analysis: a practitioner's guide. Annu Rev Public Health 2016;37:17-32. DOI: 10.1146/annurev-publhealth-032315-021402.   29. Lange T, Vansteelandt S, Bekaert M. A simple unified approach for es-timating natural direct and indirect effects. Am J Epidemiol 2012;176(3):190-195. DOI: 10.1093/aje/kwr525.   30. Burches E, Burches M. Efficacy, effectiveness and efficiency in the health care: the need for an agreement to clarify its meaning. Int Arch Public Health Community Med 2020;4(1):DOI: 10.23937/2643-4512/1710035.  33. Groeniger JO, Burdorf A. Advancing mediation analysis in occupational health research. Scand J Work Environ Health 2020;46(2):113-116. DOI: 10.5271/sjweh.3886.   35. Field-Fote EE. Mediators and moderators, confounders and covariates: exploring the variables that illuminate or obscure the “ Active Ingredi-ents” in neurorehabilitation. J Neurol Phys Ther 2019;43(2):83-84. DOI: 10.1097/NPT.0000000000000275.   37. House JS, Lantz PM, Herd P. Continuity and change in the social stratification of aging and health over the life course: evidence from a nationally representative longitudinal study from 1986 to 2001/2002 (Amer-icans’ Changing Lives Study). J Gerontol B Psychol Sci Soc Sci 2005;60:Spec No:.(15-26):DOI: 10.1093/geronb/60.special_issue_2.s15.   38. Herd P. Do functional health inequalities decrease in old age? Educational status and functional decline among the 1931-1941 birth cohort. Res Aging 2006;28(3):375-392. DOI: 10.1177/0164027505285845.   41. Oza R, Rundell K, Garcellano M. Recurrent ischemic stroke: strategies for prevention. Am Fam Physician 2017;96(7):436-440.  42. Langhorne P, Stott DJ, Robertson L, MacDonald J, Jones L, McAlpine C, et al. Medical complications after stroke: a multicenter study. Stroke 2000;31(6):1223-1229. DOI: 10.1161/01.STR.31.6.1223.   43. Hammig B, Bouza B. Paid sick leave benefits and adherence to recom-mended screening tests among male labor workers in the United States. J Occup Environ Med 2019;61(2):102-106. DOI: 10.1097/JOM.000-0000000001481.   44. Lee H, Park JH, Floyd JS, Park S, Kim HC. Combined effect of income and medication adherence on mortality in newly treated hypertension: nationwide study of 16 million person-years. J Am Heart Assoc 2019;8(16):e013148. DOI: 10.1161/JAHA.119.013148. 
|
|













